题目内容
电解法处理含Cr2O72-离子的废水(pH=4~6)的一种方法是:往废水中加入适量NaCl,以铁为电极进行电解,同时鼓入空气,经过一段时间后,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀产生,使工业废水中铬含量低于排放标准.
(1)阴极电极反应式:
(2)加入适量NaCl的作用?
(3)鼓入空气的作用? .
(1)阴极电极反应式:
(2)加入适量NaCl的作用?
(3)鼓入空气的作用?
考点:电解原理
专题:电化学专题
分析:用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,在阴极上是重铬酸根离子得电子发生还原反应,Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去,以此来解答.
解答:
解:(1)Fe为阳极,则阳极反应为Fe-2e-=Fe2+,溶液中重铬酸根离子在阴极放电:Cr2O72-+14H++6e-=2Cr3++7H2O,故答案为:Cr2O72-+14H++6e-=2Cr3++7H2O;
(2)因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强废水的导电性,便于电解的进行;
(3)亚铁离子具有还原性可以被空气中的氧气氧化为铁离子,所以鼓入空气,是将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去,故答案为:将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去.
(2)因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强废水的导电性,便于电解的进行;
(3)亚铁离子具有还原性可以被空气中的氧气氧化为铁离子,所以鼓入空气,是将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去,故答案为:将阳极溶解生成的Fe2+转化为Fe3+,便于形成沉淀除去.
点评:本题考查电解原理及氧化还原反应,明确电极时解答本题的关键,熟悉发生的电极反应及氧化还原反应即可解答,题目难度中等.

练习册系列答案
相关题目
下列物质的转化在给定条件下能实现的是( )
①Fe
Fe2O3
Fe2(SO4)3
②SiO2
Na2SiO3
H2SiO3
③AlCl3
Al
NaAlO2
④Na
Na2O
NaOH
⑤SO2
H2SO3
H2SO4.
①Fe
| O2 |
| 点燃 |
| H2SO4 |
②SiO2
| NaOH |
| HCl |
③AlCl3
| 电解 |
| NaOH |
④Na
| O2 |
| 点燃 |
| H2O |
⑤SO2
| H2O |
| O2 |
| A、①⑤ | B、②③ | C、②⑤ | D、③④ |
下列关于电解饱和食盐水制取氯气的说法正确的是( )
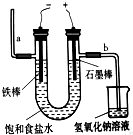

| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
某气态的烷烃与烯烃的混合气体9g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2g,则原混合气体的组成为( )
| A、甲烷,乙烯 |
| B、乙烷,乙烯 |
| C、甲烷,丙烯 |
| D、甲烷,丁烯 |

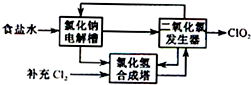 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.