题目内容
如图所示,将铁棒和石墨棒插入1Lmol?L食盐水中,下列说法错误的是( )


| A、若电键K与N连接,铁为负极 |
| B、若电键K与N连接,正极反应式是O2+2H2+4e-═4OH- |
| C、若电键K与M连接,将石墨棒成铜棒,可实现铁棒上镀铜 |
| D、若电键K与M连接,当两极共产生28L(标准状况)气体是,生成了1molNaOH |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:若电键K与N连接,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;
若电键K与M连接,该装置是电解池,碳作阳极,铁作阴极,阳极上氯离子放电,阴极上氢离子放电.
若电键K与M连接,该装置是电解池,碳作阳极,铁作阴极,阳极上氯离子放电,阴极上氢离子放电.
解答:
解:A、若电键K与N连接,该装置构成了原电池,较活泼的金属铁作负极,故A正确;
B、若电键K与N连接,该装置构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,故B正确;
C.若电键K与M连接,构成电解池,将石墨棒换成铜棒,是电解池的阳极,铁棒是阴极,电解质溶液换成CuSO4溶液就可以实现铁棒上镀铜,如果电解质溶液仍然是氯化钠溶液,不能实现铁棒上镀铜,故C错误;
D.若电键K与M连接,该装置是电解池,电池反应式为:2NaCl+2H2O
2NaOH+Cl2↑+H2 ↑,假设只发生2NaCl+2H2O
2NaOH+Cl2↑+H2 ↑,根据方程式知,当两极共产生28 L(标准状况)体时,生成了1.25molNaOH,实际上氯化钠只有1mol,与实际不符合,则电解过程中还电解水,所以当氯化钠完全解时,根据原子守恒生成的氢氧化钠是1mol,故D正确;
故选C.
B、若电键K与N连接,该装置构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,故B正确;
C.若电键K与M连接,构成电解池,将石墨棒换成铜棒,是电解池的阳极,铁棒是阴极,电解质溶液换成CuSO4溶液就可以实现铁棒上镀铜,如果电解质溶液仍然是氯化钠溶液,不能实现铁棒上镀铜,故C错误;
D.若电键K与M连接,该装置是电解池,电池反应式为:2NaCl+2H2O
| ||
| ||
故选C.
点评:本题考查原电池和电解池原理,明确电极上发生的反应是解本题关键,注意电解池中阳极如果是活泼电极发生的电极反应,为易错点,题目难度中等.

练习册系列答案
相关题目
T℃时,体积相等的甲、乙、丙3个密闭的容器中,发生反应:CO2(g)+H2(g)?CO(g)+H2O(g),起始时充入各物质的物质的量如下表所示( )
则达到平衡时,CO的物质的量由大到小的顺序是.
| CO2 | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| A、n(甲)>n(乙)>n(丙) |
| B、n(甲)>n(丙)>n(乙) |
| C、n(乙)>n(丙)>n(甲) |
| D、n(乙)>n(甲)>n(丙) |
化学在人类生活中扮演着重要角色,以下说法或应用正确的是( )
| A、皂化反应指酯类物质发生碱性水解 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
广告称某品牌的八宝粥(含桂圆、红豆、糯米等)不加糖,比加糖还甜,适合糖尿病人食用.你认为下列判断不正确的是( )
| A、这个广告有误导喜爱甜食消费者的嫌疑 |
| B、糖尿病人应少吃含糖的食品,该八宝粥未加糖,可以放心食用 |
| C、不加糖不等于没有糖,糖尿病人食用需慎重 |
| D、不能听从厂商或广告商的宣传,应询问医生 |
下列物质的转化在给定条件下能实现的是( )
①Fe
Fe2O3
Fe2(SO4)3
②SiO2
Na2SiO3
H2SiO3
③AlCl3
Al
NaAlO2
④Na
Na2O
NaOH
⑤SO2
H2SO3
H2SO4.
①Fe
| O2 |
| 点燃 |
| H2SO4 |
②SiO2
| NaOH |
| HCl |
③AlCl3
| 电解 |
| NaOH |
④Na
| O2 |
| 点燃 |
| H2O |
⑤SO2
| H2O |
| O2 |
| A、①⑤ | B、②③ | C、②⑤ | D、③④ |
下列说法中正确的是( )
| A、一定条件下下向1L容器内通入46gNO2,则NO2 的物质的量浓度一定为1mol/L |
| B、标况下22.4L的己烷中有20NA原子 |
| C、1mol氯气溶于水转移1mol e- |
| D、1molNa2O2与足量水反应,转移1mol e-,生成0.5molO2 |
下列关于氢化物的叙述中正确的是( )
| A、稳定性:H2S>HF |
| B、在卤化物中HF最稳定 |
| C、一个D2O分子所含的中子数为8 |
| D、HCl是离子化合物 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a﹙并滴有酚酞溶液﹚;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a﹙并滴有酚酞溶液﹚;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: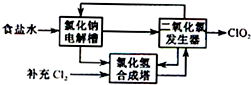 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.