题目内容
7. 过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:(1)H2O2的电子式为
 .
.(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ/mol
2H2O2(1)═2H2O(l)+O2(g)△H=-196kJmol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol.
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4$\frac{\underline{\;通电\;}}{\;}$(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物.则:
①电解时阳极的电极反应式为2SO42--2e-=S2O82-;
②(NH4)2S2O8水解时发生反应的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变).甲小组有如下实验设计方案.
| 实验编号 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL5%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
①甲小组实验得出的结论是H2O2分解时,MnO2比Fe2O3催化效率更高.
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为BaO2+2H++SO42-═BaSO4↓+H2O2;支持这一方案的理由是(BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因).
③已知过氧化氢还是一种极弱的二元酸:H2O2?H++HO2-(K${\;}_{{a}_{1}}$=2.4×10-12).当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-?HO2-+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为1.33×104(保留3位有效数字).
分析 (1)H2O2中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)①电解硫酸氢铵水溶液得到(NH4)2S2O8和H2,电解池中阴极是得到电子发生还原反应,阳极SO42-失去e-生成S2O82-;
②(NH4)2S2O8溶液水解得到过氧化氢的水溶液,则(NH4)2S2O8水解生成双氧水和硫酸氢铵;
(4)①在体积-时间图,斜率即可代表化学反应速率,甲组实验Ⅰ、II催化剂不同;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快;根据BaO2固体与硫酸溶液反应制H2O2和硫酸钡进行解答;
③根据K${\;}_{{a}_{1}}$、KW、以及V正、v逆公式进行计算.
解答 解:(1)H2O2为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为 ,
,
故答案为: ;
;
(2)①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196kJ/mol,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
由盖斯定律①+$\frac{1}{2}$×②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol;
(3)①电解硫酸氢铵水溶液得到(NH4)2S2O8和H2,电解池中阴极是得到电子的,所以为溶液中的氢离子放电,方程式是2H++2e-═H2↑,阳极SO42-失去e-生成S2O82-,阳极的电极反应方程是:2SO42--2e-=S2O82-,
故答案为:2SO42--2e-=S2O82-;
②(NH4)2S2O8水解得到H2O2和另一产物,另一产物为NH4HSO4,反应方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2,
故答案为:(NH4)2S2O8+2H2O=2NH4HSO4+H2O2;
(4)①由图象可知在体积-时间图,斜率即可代表化学反应速率,由甲组实验两条曲线可知,甲组实验Ⅱ斜率大,因此分解速率越快,说明H2O2分解时,MnO2比Fe2O3催化效率更高,
故答案为:H2O2分解时,MnO2比Fe2O3催化效率更高;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析可知碱性越强,放出气体的速率越快,由题意知BaO2固体与H2SO4溶液反应制H2O2的反应物为BaO2和H2SO4,产物为H2O2,根据原子守恒可知另一种产物为硫酸钡,即:BaO2+H2SO4=H2O2+BaSO4↓,离子方程式为:BaO2+2H++SO42-═BaSO4↓+H2O2,由图可知酸性条件下,H2O2分解的速率慢,相同条件下H2O2在碱性条件下快,可能BaSO4的生成有利于平衡右移即有利于H2O2的生成,或酸性环境有利于H2O2的存在(等其他合理原因),
故答案为:碱;BaO2+2H++SO42-═BaSO4↓+H2O2;(BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因);
③水的物质的量浓度为55.6 mol/L,$\frac{k正}{k逆}$=$\frac{c({H}_{2}O)•c(H{{O}_{2}}^{-}),}{C({H}_{2}{O}_{2})•C(O{H}^{-})}$=$\frac{C({H}_{2}O)•{K}_{a}}{{K}_{W}}$=$\frac{55.6×2.4×1{0}^{-12}}{1.0×1{0}^{-14}}$≈1.33×104,
故答案为:1.33×104.
点评 本题考查过氧化氢的有关知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意外界因素对化学反应速率的影响,(4)③计算是该题的难点,题目难度中等.

C3H8+5O2═3CO2+4H2O,2Zn+O2═2ZnO.用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是( )
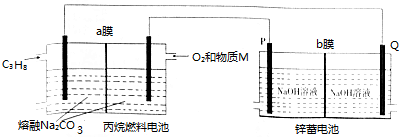
| A. | 物质M为CO2 | |
| B. | 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动 | |
| C. | a膜、b膜均适宜选择阴离子交换膜 | |
| D. | 该装置中,锌蓄电池的正极反应式为Zn+2OH--2e-═ZnO+H2O |
| A. | FeSO4(aq)$\stackrel{氢气}{→}$Fe$→_{高温}^{H_{2}O(g)}$Fe2O3 | |
| B. | Cu2S$→_{高温}^{O_{2}}$Cu$\stackrel{FeCl_{3}(aq)}{→}$CuCl2(aq) | |
| C. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$→_{H_{2}O}^{SO_{2}(足量)}$HClO | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 |
| A. | C7H12O4,4种 | B. | C7H12O4,6种 | C. | C7H14O2,8 种 | D. | C7H14O2,10种 |
| A. |  图中甲可能是Cl2,X可能是Fe | |
| B. |  图中反应一定是置换反应或复分解反应 | |
| C. |  图中是向某溶液中滴加NaOH溶液的变化图象,原溶质可能是Al2(SO4)3 | |
| D. |  图中a可能为NaOH,b可能为Na2CO3,c可能为NaHCO3 |
| A. | 蛋白质溶液中加Na2SO4可使其变性 | |
| B. | 乙烷、苯、葡萄糖溶液均不能使酸性KMnO4溶液褪色 | |
| C. | 有机物CH2=CHCH(CH3)Cl能发生加成反应、取代反应、缩聚反应、氧化反应 | |
| D. | 分子式为C4H7ClO2且能与NaHCO3反应放出气体的有机物结构有5种(不包含立体异构) |
| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Cu2+、SO42-、Cl- | ||
| C. | Al3+、Fe2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、CO32- |
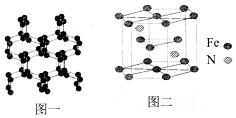 南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题:
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题: .
.