题目内容
12.1mol酯R完全水解可得到l molC5H8O4和2mol甲醇,下列有关酯R的分子式和分子结构数目正确的是( )| A. | C7H12O4,4种 | B. | C7H12O4,6种 | C. | C7H14O2,8 种 | D. | C7H14O2,10种 |
分析 1mol该酯完全水解可得到l molC5H8O4和2mol甲醇,则说明酯中含有2个酯基,结合酯的水解特点以及质量守恒定律判断酯R分子式,含二个-COOCH3基团,可以看成丙烷的二元取代产物,据此书写分子结构.
解答 解:1mol该酯完全水解可得到l molC5H8O4和2mol甲醇,则说明酯中含有2个酯基,设酯R为M,
则反应的方程式为M+2H2O=C5H8O4+2CH3OH,
由质量守恒可知M的分子式为C7H12O4,其中只含二个-COOCH3基团,可以看成丙烷的二元取代产物,含两个-COOCH3基团的R的同分异构体共有4种:CH3CH2CH(COOCH3)2,CH3OOCCH2CH(CH3)CH2COOCH3,CH3OOCCH2CH2CH2COOCH3, ,
,
故选A.
点评 本题考查有机物的推断,为高频考点,侧重分析与应用能力的考查,把握酯化反应中碳原子个数变化、官能团的变化为推断的关系,侧重酯的性质的考查,题目难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
3.已知由CH4、C2H2、C2H4、C2H6四种气态烃中的某两种烃组成的混合气体0.1mol,完全燃烧得0.14molCO2和4.32gH2O,则这两种烃的物质的量之比可能为( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 2:5 |
20.为了检验某氯化烃中的氯元素,现进行如下操作.其中合理的是( )
| A. | 取氯代烃少许,加入AgNO3溶液 | |
| B. | 取氯代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取氯代烃少许与NaOH水溶液共热后,加入稀硝酸酸化,再加入AgNO3 | |
| D. | 取氯代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入AgNO3溶液 |
7. 过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
(1)H2O2的电子式为 .
.
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ/mol
2H2O2(1)═2H2O(l)+O2(g)△H=-196kJmol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol.
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4$\frac{\underline{\;通电\;}}{\;}$(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物.则:
①电解时阳极的电极反应式为2SO42--2e-=S2O82-;
②(NH4)2S2O8水解时发生反应的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变).甲小组有如下实验设计方案.
甲、乙两小组得出如图数据.
①甲小组实验得出的结论是H2O2分解时,MnO2比Fe2O3催化效率更高.
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为BaO2+2H++SO42-═BaSO4↓+H2O2;支持这一方案的理由是(BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因).
③已知过氧化氢还是一种极弱的二元酸:H2O2?H++HO2-(K${\;}_{{a}_{1}}$=2.4×10-12).当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-?HO2-+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为1.33×104(保留3位有效数字).
 过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:(1)H2O2的电子式为
 .
.(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ/mol
2H2O2(1)═2H2O(l)+O2(g)△H=-196kJmol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol.
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4$\frac{\underline{\;通电\;}}{\;}$(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物.则:
①电解时阳极的电极反应式为2SO42--2e-=S2O82-;
②(NH4)2S2O8水解时发生反应的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变).甲小组有如下实验设计方案.
| 实验编号 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL5%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
①甲小组实验得出的结论是H2O2分解时,MnO2比Fe2O3催化效率更高.
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为BaO2+2H++SO42-═BaSO4↓+H2O2;支持这一方案的理由是(BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因).
③已知过氧化氢还是一种极弱的二元酸:H2O2?H++HO2-(K${\;}_{{a}_{1}}$=2.4×10-12).当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-?HO2-+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为1.33×104(保留3位有效数字).
17.化学与生活密切相关,下列叙述中正确的是( )
| A. | 纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质 | |
| B. | 补钙剂中常含有维生素D,其作用是为了促进钙的吸收 | |
| C. | 天然存在的动植物油脂,大多属于单甘油酯 | |
| D. | 蛋白质的盐析属于化学变化,可用于分离、提纯蛋白质 |
4.化学与生产、生活密切相关,下列有关说法不正确的是( )
| A. | 水玻璃是用于生产硅胶、木材防火剂、粘合剂的原料 | |
| B. | 可以用氢氧化钠溶液鉴别地沟油和矿物油 | |
| C. | CaCO3分解,Ba(OH)2•8H2O和NH4Cl 反应,高温下铝与氧化铁的反应都是吸热反应 | |
| D. | 淀粉、蛋白质、有机玻璃、天然橡胶都是高分子化合物 |
1.设NA为阿伏加德罗常数的数值.下列有关叙述正确的是( )
| A. | 1mol苯完全转化为环己烷,参与反应的碳碳双键数为3NA | |
| B. | 常温下,2.7 gAl与足量浓度为18 mo1/L的浓硫酸反应时,转移的电子数为0.3NA | |
| C. | 1L 2mol•L-1CH3COONH4 溶液中含有的NH4+数目为2NA | |
| D. | 标准状况下,22.4L的CCl4含有的CCl4分子数大于NA |
2.NH3是一种重要的化工原料,可以制备一系列物质(如图).下列有关表述正确的是( )

| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl和HNO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的盐类物质均为含氧酸盐 |
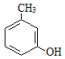 +CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$
+CH3COCH2COOC2H5$→_{10℃搅拌12h}^{浓硫酸}$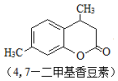 +C2H5OH+H2O
+C2H5OH+H2O