题目内容
17.在透明的酸性溶液中能大量共存的离子组是( )| A. | Ba2+、K+、OH-、NO3- | B. | NH4+、Cu2+、SO42-、Cl- | ||
| C. | Al3+、Fe2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、CO32- |
分析 酸性溶液中存在大量氢离子,能够与氢离子反应的离子不能大量共存,
A.氢氧根离子与氢离子反应;
B.四种离子之间不反应,都不与氢离子反应;
C.酸性条件下硝酸根离子能够氧化亚铁离子;
D.钙离子、氢离子与碳酸根离子反应.
解答 解:酸性溶液中存在大量氢离子,能够与氢离子反应的离子不能大量共存,
A.OH-与氢离子反应,在溶液中不能大量共存,故A错误;
B.NH4+、Cu2+、SO42-、Cl-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故B正确;
C.Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.H+、Ca2+都与CO32-发生反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
7. 过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
(1)H2O2的电子式为 .
.
(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ/mol
2H2O2(1)═2H2O(l)+O2(g)△H=-196kJmol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol.
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4$\frac{\underline{\;通电\;}}{\;}$(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物.则:
①电解时阳极的电极反应式为2SO42--2e-=S2O82-;
②(NH4)2S2O8水解时发生反应的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变).甲小组有如下实验设计方案.
甲、乙两小组得出如图数据.
①甲小组实验得出的结论是H2O2分解时,MnO2比Fe2O3催化效率更高.
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为BaO2+2H++SO42-═BaSO4↓+H2O2;支持这一方案的理由是(BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因).
③已知过氧化氢还是一种极弱的二元酸:H2O2?H++HO2-(K${\;}_{{a}_{1}}$=2.4×10-12).当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-?HO2-+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为1.33×104(保留3位有效数字).
 过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:
过氧化氢(H2O2)俗称双氧水.是一种重要的化工产品,具有漂白、氧化、消毒、杀菌等多种功效,广泛应用于纺织、造纸、化工、电子、轻工、污水处理等工业.回答下列问题:(1)H2O2的电子式为
 .
.(2)用H2O2与稀硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ/mol
2H2O2(1)═2H2O(l)+O2(g)△H=-196kJmol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol
则在稀硫酸溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-320kJ/mol.
(3)工业上常用电解硫酸氢铵水溶液的方法制备过氧化氢,其原理为:首先2NH4HSO4$\frac{\underline{\;通电\;}}{\;}$(NH4)2S2O8+H2↑,然后由(NH4)2S2O8水解得到H2O2和另一产物.则:
①电解时阳极的电极反应式为2SO42--2e-=S2O82-;
②(NH4)2S2O8水解时发生反应的化学方程式为(NH4)2S2O8+2H2O=2NH4HSO4+H2O2.
(4)现甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变).甲小组有如下实验设计方案.
| 实验编号 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL5%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
①甲小组实验得出的结论是H2O2分解时,MnO2比Fe2O3催化效率更高.
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在碱(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2固体与硫酸溶液反应制H2O2,其反应的离子方程式为BaO2+2H++SO42-═BaSO4↓+H2O2;支持这一方案的理由是(BaSO4的生成有利于平衡右移即有利于H2O2的生成)酸性环境有利于H2O2的存在(等其他合理原因).
③已知过氧化氢还是一种极弱的二元酸:H2O2?H++HO2-(K${\;}_{{a}_{1}}$=2.4×10-12).当稀H2O2溶液在碱性环境下分解时会发生反应H2O2+OH-?HO2-+H2O,该反应中,正反应速率为V正=k正•c(H2O2)•c(OH-),逆反应速率为v逆=k逆•c(H2O)•c(HO2-),其中k正、k逆为速率常数,则k正与k逆的比值为1.33×104(保留3位有效数字).
8.化学与生活、生产紧密相关,对下列现象或事实的解释正确的选项是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的烧碱溶液洗涤餐具 | NaOH能使油脂发生水解反应 |
| B | 向普通钢材中添加少量镍、铬等其它金属 | 形成合金,保护铁不被腐蚀 |
| C | 处理锅炉内壁的水垢需使用Na2CO3溶液 | 将Mg(OH)2转化为更难溶的MgCO3 |
| D | 使用明矾净水 | 明矾溶液显酸性 |
| A. | A | B. | B | C. | C | D. | D |
5.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
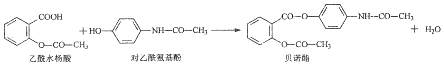
下列有关叙述不正确的是( )

下列有关叙述不正确的是( )
| A. | 贝诺酯分子中有2种含氧官能团 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | lmol乙酰水杨酸最多消耗3molNaOH | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氮基酚钠 |
12.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| B. | 标准状况下22.4 L H2 中含中子数为2NA | |
| C. | 1L 1mol/L醋酸溶液中离子总数为2NA | |
| D. | 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
2.NH3是一种重要的化工原料,可以制备一系列物质(如图).下列有关表述正确的是( )

| A. | NH4Cl和NaHCO3都是常用的化肥 | |
| B. | NH4Cl和HNO3受热时都易分解 | |
| C. | NH3和NO2在一定条件下可发生氧化还原反应 | |
| D. | 图中所涉及的盐类物质均为含氧酸盐 |
1.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 其他条件相同,测定等浓度的HCOOK和K2S溶液的PH | 比较Ka(HCOOH)和K${\;}_{{a}_{2}}$(H2S)的大小 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| D | C2H5OH与浓硫酸混合后加热到170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
