题目内容
4.用足量H2还原一定质量的氧化铜粉末,反应一段时间后,测得固体质量减少8g,此时消耗H222.4L(标准状况下),求生成Cu的质量.分析 发生反应的化学方程式为CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,利用差量法可直接计算出生成Cu的质量.
解答 解:CuO中通入氢气,发生CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,设有xgCu生成,
CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O△m
80g 64g 16g
x 8g
则x=$\frac{64g×8g}{16g}$=32g,
答:生成Cu的质量为32g.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力的考查,注意利用差量法计算较为简单,易错点为氢气的体积,注意氢气不能全部反应的特点,难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
10.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 标准状况下,22.4 L Cl2与足量水反应,转移的电子数目等于NA | |
| B. | 17 g-18OH所含的电子数目为9NA | |
| C. | 16 g N2 H4中含有的非极性共价键数目为0.5NA | |
| D. | 常温时,1 L pH=12的 Ba(OH)2溶液中含OH一的数目为2×10-2NA |
12.某无色溶液中,加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是( )
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、Br-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | Na+、Mg2+、Br-、SO42- |
19.将4.3g Na、Na2O2、Na2O的混合物与足量水反应,在标准状况下得到672mL混合气体,将气体在密闭容器中放电后冷却到标准状况下,发现容器内压强接近于零,则原混合物中Na、O元素的物之比为( )
| A. | 1:1 | B. | 1:2 | C. | 4:3 | D. | 2:1 |
9.下列与NH4Fe(SO4)2•24H2O溶液有关描述及离子方程式正确的是( )
| A. | 该溶液中H+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 该溶液中滴入少量NaOH溶液:3NH4++Fe3++6OH-=3NH3↑+Fe(OH)3↓ | |
| C. | 该溶液中加入足量的Zn粉:2Fe3++Zn=Zn2++2Fe2+ | |
| D. | 先加盐酸再加入BaCl2溶液:SO42-+Ba2+=BaSO4↓ |
16.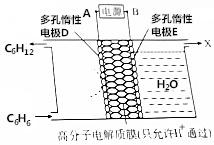 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
13.一定温度下,在恒容密闭容器中发生可逆反应N2+3H2?2NH3,已知某时刻存在N2、H2、NH3的浓度为1mol•L-1、2mol•L-1、2mol•L-1,当达到平衡状态可能存在的数据是( )
| A. | N2为$\frac{1}{3}$mol•L-1 | B. | NH3为$\frac{10}{3}$mol•L-1 | ||
| C. | H2为5.5mol•L-1 | D. | N2为1.5mol•L-1,H2为3.5mol•L-1 |
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 64gCaC2中含有的共价键数目为3NA | |
| B. | 20gD2O与20gH218O含有的中子数均为11NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |