题目内容
7.下列各组反应中关于能量的比较正确的是( )①H2(g)+Cl2(g)=2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2;△H1>△H2
②2H2O(l)=2H2(g)+O2(g)△H1;2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2;△H1>△H2
③CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1
CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
④t℃时,在一定条件下,将1molN2和3molH2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2,Q1<Q2.
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
分析 ①氯气和氢气的化合为放热反应并且焓变与系数成正比;
②H2O分解为吸热,Na与H2O反应为放热;
③液态乙醇转化为气态乙醇的过程是吸收热量的;
④因为1molN2和3molH2反应生成氨气为气体体积减小的反应,所以恒容相对于在恒压的基础上增大体积即减小压强,平衡逆向移动,据此分析.
解答 解:①氯气和氢气的化合为放热反应,所以焓变为负值,又焓变与系数成正比,所以H2(g)+Cl2(g)=2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g)△H2;△H1<△H2,故错误;
②H2O分解为吸热,则2H2O(l)=2H2(g)+O2(g)△H1>0;Na与H2O反应为放热,则2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2<0;所以△H1>△H2,故正确;
③液态乙醇转化为气态乙醇的过程是吸收热量的,所以气态乙醇燃烧放热多,则△H1<△H2,故正确;
④因为1molN2和3molH2反应生成氨气为气体体积减小的反应,所以恒容相对于在恒压的基础上增大体积即减小压强,平衡逆向移动,则放出热量减小,所以Q1<Q2,故正确;
故选C.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
相关题目
14.除去物质中含少量杂质的方法错误是( )
| 选项 | 物质(括号内为杂质) | 实验方法 |
| A | K2SO4 (K2CO3) | 加入稀硫酸使溶液呈中性 |
| B | NaCl (KNO3) | 样品配制成热饱和溶液,冷却结晶,过滤 |
| C | CO2(HCl) | 通过NaHCO3饱和溶液,干燥 |
| D | 溴苯(溴) | 加入足量NaOH溶液,充分振荡,分液 |
| A. | A | B. | B | C. | C | D. | D |
2.检验烧碱溶液中是否含有少量的纯碱的方法是( )
| A. | 加入少量盐酸观察是否有气体产生 | |
| B. | 加热观察是否有气体产生 | |
| C. | 加入过量盐酸观察是否有气体产生 | |
| D. | 加入少量碳酸氢钙溶液观察是否有沉淀产生 |
12.某无色溶液中,加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是( )
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、Br-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | Na+、Mg2+、Br-、SO42- |
19.将4.3g Na、Na2O2、Na2O的混合物与足量水反应,在标准状况下得到672mL混合气体,将气体在密闭容器中放电后冷却到标准状况下,发现容器内压强接近于零,则原混合物中Na、O元素的物之比为( )
| A. | 1:1 | B. | 1:2 | C. | 4:3 | D. | 2:1 |
16.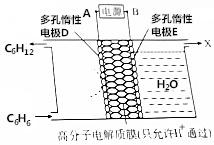 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
17.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)?pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )
| A. | m+n>p | B. | m+n<p | ||
| C. | 平衡向正反应方向移动 | D. | C的质量分数增加 |
 二氧化硫在生产和生活中有重要的应用.
二氧化硫在生产和生活中有重要的应用. S+2CO2.
S+2CO2.