题目内容
9.化学与人类社会的生产、生活有着密切联系.下列叙述中正确的是( )| A. | 铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| B. | 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中 | |
| C. | 苹果放在空气中久置变黄和漂白过纸张久置变黄原理相似 | |
| D. | 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能 |
分析 A.Cu不能置换酸中的氢离子;
B.Al在常温下能被氧气氧化生成致密的氧化膜;
C.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子;
D.SiO2可制造光导纤维,光电池中的材料为单质硅.
解答 解:A.Cu不能置换酸中的氢离子,所以铜制品不能发生析氢腐蚀,故A错误;
B.Al在常温下能被氧气氧化生成致密的氧化膜,致密的氧化膜能防止内部金属继续被氧化,故B正确;
C.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子,二者原理不相同,故C错误;
D.SiO2可制造光导纤维,SiO2没有导电性不能制造光电池,光电池中的材料为单质硅,故D错误.
故选B.
点评 本题考查了元素化合物的性质及用途,题目难度不大,考查了化学知识在生产生活中的应用,注意把握常见物质的性质和用途.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
19.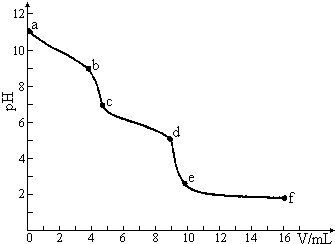 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
20.下列对应的离子方程式正确的有( )
| A. | 漂白粉溶液通入SO2:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 少量的Na2SO3溶液滴加到足量稀盐酸中:SO32-+2H+═H2O+SO2↑ | |
| D. | 硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H20═H2SiO3(胶体)+CO32- |
1.DDT是被禁用的有机污染物,它的结构简式为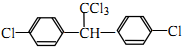 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )
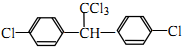 .下列有关DDT的说法正确的是( )
.下列有关DDT的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共平面 | ||
| C. | 分子式为C14H9Cl5 | D. | 能发生水解反应和消去反应 |
10.室温下,将0.1molK2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质.有关结论正确的是( )
| 加入的物质 | 结论 | |
| A | 100mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| B | 0.01molK2O | 溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(O{H}^{-})}$ 增大 |
| C | 50mL 1mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| D | 0.1molKHSO4固体 | 反应结束后,溶液pH=7 |
| A. | A | B. | B | C. | C | D. | D |
 .
.
