题目内容
3.下列关于Fe3+、Fe2+性质实验的说法错误的是( )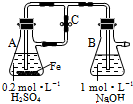
| A. | 用图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
分析 由图可知,A中发生Fe与稀硫酸的反应生成硫酸亚铁和氢气,利用氢气将装置中的空气排出,然后关闭C,氢气将硫酸亚铁压入B中,硫酸亚铁与NaOH反应生成Fe(OH)2,该实验能防止Fe(OH)2被氧化,检验铁离子利用KSCN溶液,以此来解答.
解答 解:由图可知,A中发生Fe与稀硫酸的反应生成硫酸亚铁和氢气,利用氢气将装置中的空气排出,然后关闭C,氢气将硫酸亚铁压入B中,硫酸亚铁与NaOH反应生成Fe(OH)2,
解:A.反应开始时生成的氢气进入B中,可排出氧气,防止生成的氢氧化亚铁被氧化,一段时间后关闭止水夹C,A中硫酸亚铁进入B中可生成Fe(OH)2,故A正确;
B.FeCl3易水解,配制溶液时应防止溶液因水解而生成氢氧化铁沉淀,可先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,故B正确;
C.FeCl3溶液中滴加KSCN溶液,溶液变红色,无沉淀,故C错误;
D.Fe3+与铁反应可生成Fe2+,则向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化,故D正确.
故选C.
点评 本题考查化学实验方案的评价及性质实验,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
13.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A. | FeCl3 | B. | Cu(NO3)2 | C. | Na2SO3 | D. | Al2(SO4)3 |
8.设NA为阿伏加德罗常数的值,N表示粒子数目,下列叙述不正确的是( )
| A. | 标准状况下,22.4 LHF中分子总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| D. | .将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA |
15.下列关于热化学反应的描述中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 1mol甲烷燃烧生成水蒸汽和二氧化碳所放出的热量就是甲烷的燃烧热 | |
| C. | CO(g)的燃烧热△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol | |
| D. | 已知中和热△H=-57.3kJ/mol,则稀H2SO4和Ba(OH)2溶液反应生成2molH2O的反应热△H=-114.6kJ/mol |
12.Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3全部溶解,向所得溶液中加入KSCN无明显现象,为使Fe元素恰好全部转化为沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为( )
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |