题目内容
3. 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为硫酸.工作时该电池总反应式为Pb+PbO2+2H2SO4═2PbSO4+2H2O.根据上述情况判断:蓄电池的负极材料是铅,电极反应为Pb-2e-+SO42-=PbSO4;工作时,电解质溶液中阴离子移向负极.(填“正”或“负”);若外电路有0.2mol电子通过,正极质量理论上增加6.4g.
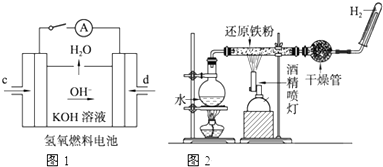
(2)燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.常见的燃料电池有氢氧燃料电池、烷氧燃料电池、醇氧燃料电池等,如图氢氧燃料电池示意图:
①若电解液为KOH溶液,则电池工作时负极的电极反应为:2H2+4OH--4e-=2H2O;正极的电极反应为:O2+2H2O+4e-=4OH-.
②若电解液为H2SO4溶液,则电池工作时正极的电极反应为:O2+4H++4e-=2H2O.
③若将上述燃料电池中的氢气改为CH4,以硫酸做电解质,则负极的电极反应为:CH4-8e-+2H2O=CO2+8H+.
分析 (1)放电时,铅失电子,铅作负极,铅的化合价升高被氧化成二价铅离子,并与硫酸反应生成硫酸铅;工作时,电解质溶液中阴离子移向负极;根据转移电子的物质的量之间的关系式计算;
(2)①燃料电池中,通入燃料的电极是负极,负极上燃料氢气失电子发生氧化反应生成氢离子,氢离子与电解质溶液中的氢氧根反应生成水,通入氧化剂的电极是正极,正极上氧化剂氧气得电子发生还原反应;
②若电解液为H2SO4溶液,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水;
③把氢气改为甲烷,以硫酸做电解质,负极上甲烷失电子生成二氧化碳和氢离子.
解答 解:(1)放电时,铅作负极,负极上铅失电子和硫酸反应生成硫酸铅,电极反应式为:Pb-2e-+SO42-=PbSO4;工作时,电解质溶液中阴离子移向负极;放电时,正极上PbO2得电子和H2SO4反应生成PbSO4,电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O,关系式为:PbO2~2e-~PbSO4,当外电路通过2mol电子时,生成1molPbSO4,正极增重的质量可以看作1molSO2的质量,即64g,若外电路有0.2mol电子通过,正极质量理论上增加6.4g,
故答案为:铅;Pb-2e-+SO42-=PbSO4;负;6.4;
(2)①燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,所以通入氢气的电极是负极、通入氧气的电极是正极,负极上电极反应式为2H2+4OH--4e-=2H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,
故答案为:2H2+4OH--4e-=2H2O;O2+2H2O+4e-=4OH-;
②若电解液为H2SO4溶液,负极上氢气失电子生成氢离子,正极上氧气得电子和氢离子反应生成水,所以负极电极反应式为2H2-4e-=4H+,正极电极反应式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
③若把H2改为CH4,以硫酸做电解质,负极上甲烷失电子生成二氧化碳和氢离子,电极反应式为CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+.
点评 本题考查了原电池原理,根据原电池正负极上得失电子确定发生的电极反应,难点是电极反应式的书写,书写时要结合电解质溶液酸碱性,燃料、氧化剂相同,但电解质溶液酸碱性不同,其电极反应式不同,为易错点.

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案| A. | 单位时间内生成2mol H2的同时消耗了1mol CO | |
| B. | c(CO):c(CH3OH)=1:1 | |
| C. | 在恒温恒容的容器中,混合气体的压强保持不变 | |
| D. | 在绝热恒容的容器中,反应的平衡常数不再变化 |
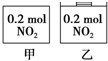 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
| A. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| B. | 机动车实行限行措施是减少雾霾的途径之一 | |
| C. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
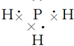 ,结构式
,结构式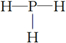 .
.