题目内容
15.如图所示装置工作时均与H2有关.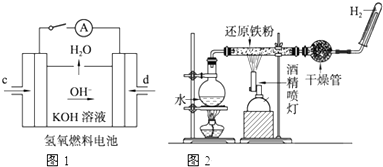
①图1所示装置中,通入H2的管口的电极反应式为H2+2e-+2OH-=2H20.
②某同学按图2所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论不严密(填“严密”或“不严密”),你的理由是产物中含+3价铁的物质与稀硫酸反应后生成Fe3+,Fe3+可与过量的Fe反应生成Fe2+,2Fe3++Fe═3Fe2+(用离子方程式和必要的文字说明).
分析 ①根据氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水;
②根据反应现象知,溶液中没有铁离子,原因是部分铁未被氧化,导致剩余的铁和铁离子反应生成亚铁离子.
解答 解:①氢氧燃料碱性电池中,氢气失电子和氢氧根离子反应生成水,反应式为H2-2e-+2OH-=2H2O.
故答案为:H2-2e-+2OH-=2H2O;
②铁和水蒸气在高温下反应生成四氧化三铁和氢气,根据反应现象知,该反应中部分铁未参加反应导致剩余的铁和铁离子反应生成二价铁离子,
离子方程式为:2Fe3++Fe=3Fe2+,所以说不严密.
故答案为:不严密; 产物中含+3价铁的物质与稀硫酸反应后生成Fe3+,Fe3+可与过量的Fe反应生成Fe2+,2Fe3++Fe═3Fe2+.
点评 本题考查了电化学知识.易错点是氢氧燃料电池中电极的判断,明确溶液中离子的移动方向是解此题的关键,题目难度中等.

练习册系列答案
相关题目
11.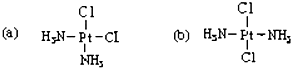 科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )
科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )
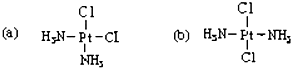 科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )
科学家发现铂的两种化合物(如图)有不同的特性,a 具有抗癌作用,而 b 没有.则 a 和 b 属于 ( )| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同一种物质 |
12.常温下,pH=3的盐酸与pH=11的氨水等体积混合后的溶液,向该溶液中滴入2~3滴酚酞,溶液的颜色可能是( )
| A. | 只显红色 | B. | 呈无色 | C. | 无色或蓝色 | D. | 红色或无色 |
10.下列说法中正确的是( )
| A. | 决定化学反应速率的主要因素是反应物的浓度、压强、温度、催化剂等 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸的起始温度.NaOH溶液的起始温度和反应后反应体系的最高温度 | |
| C. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 | |
| D. | 某可逆反应的化学平衡常数K,只随温度的改变而改变,且温度越高K值一定越大 |
7.糖类、油脂、蛋白质为食物中的基本营养物质.下列有关说法正确的是( )
| A. | 糖类、油脂、蛋白质中都只含C、H、O三种元素 | |
| B. | 糖类、油脂、蛋白质都能发生水解反应 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉、纤维素分子组成都可表示为(C6H10O5)n,二者互为同分异构体 |
4.决定物质性质的重要因素是物质结构.请回答下列问题.

(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,B元素的核外电子排布式为1s22s22p63s2.
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是TiN>MgO>CaO>KCl. 其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键.

(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(4)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键.
5.下列实验操作正确的是( )
| A. | 实验室制备肥皂,利用花生油与稀硫酸混合液在小烧杯中加热,直到油滴消失 | |
| B. | 配置菲林试剂,在硫酸铜溶液中加入少量的氢氧化钠溶液 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别汽油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
 原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答:
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.随着科学技术的不断发展,以原电池原料为基础,科学家们研制出了各式各样的化学电源,请应用原电池相关知识回答: