题目内容
7.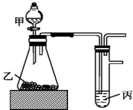 用如图装置进行实验,根据实验现象所得结论正确的是( )
用如图装置进行实验,根据实验现象所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 漂白粉溶液 | 酸性:HCl>H2CO3>HClO |
| B | 盐酸 | 硫化亚铁 | 硫酸铜溶液 | 酸性:HCl>H2S>H2SO4 |
| C | 水 | 过氧化钠 | 水 | 过氧化钠与水的反应是放热反应 |
| D | 浓盐酸 | 二氧化锰 | 碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与漂白粉溶液反应;
B.硫化氢与硫酸铜反应生成CuS沉淀,CuS不溶于酸,不能比较酸性;
C.过氧化钠与水反应放热,观察丙中有水蒸气;
D.浓盐酸与二氧化锰反应需要加热.
解答 解:A.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与漂白粉溶液反应,则该实验不能比较H2CO3、HClO的酸性,故A错误;
B.硫化氢与硫酸铜反应生成CuS沉淀,CuS不溶于酸,不能比较酸性,且硫酸、盐酸均为强酸,而H2S为弱酸,故B错误;
C.过氧化钠与水反应放热,观察丙中有水蒸气,则由实验可知过氧化钠与水的反应是放热反应,故C正确;
D.浓盐酸与二氧化锰反应需要加热,该装置不能生成氯气,不能比较氧化性,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
2.化学反应速率与化学反应限度相关知识在化工生产中应用广泛.
Ⅰ.一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:
N2(g)+3H2O(g)?2NH3(g)+$\frac{3}{2}$O2(g)△H>0,进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6mol•h-1.
(2)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.下列措施既可增加反应速率又可以增加NH3产率的是A(填序号).
A.升高温度 B.将NH3从体系中分离
C.恒容条件下,充入He D.加入合适的催化剂
(3)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.在某10L恒容的密闭容器中加入2molN2和4molH2,达到平衡时放出的热量为92.4KJ,该条件下的平衡常数为400.下列能判断该反应一定达到平衡状态的是AD(填序号).
A.容器中气体的平均相对分子质量不随时间而变化
B.2v正(NH3)═3v逆(H2)
C.N2、H2、NH3三种物质的反应速率之比为1:3:2
D.容器中总压强不随时间而变化
E.反应的△H不再变化
Ⅱ.高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的△H<0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡.求CO的平衡转化率=60%;欲提高(2)中CO的平衡转化率,可采取的措施是C(填序号).
(3)下列措施中能使平衡时$\frac{c(CO)}{c({CO}_{2})}$增大的是D(填序号).
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的体积 F.加入合适的催化剂.
Ⅰ.一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:
N2(g)+3H2O(g)?2NH3(g)+$\frac{3}{2}$O2(g)△H>0,进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成 NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6mol•h-1.
(2)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.下列措施既可增加反应速率又可以增加NH3产率的是A(填序号).
A.升高温度 B.将NH3从体系中分离
C.恒容条件下,充入He D.加入合适的催化剂
(3)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol.在某10L恒容的密闭容器中加入2molN2和4molH2,达到平衡时放出的热量为92.4KJ,该条件下的平衡常数为400.下列能判断该反应一定达到平衡状态的是AD(填序号).
A.容器中气体的平均相对分子质量不随时间而变化
B.2v正(NH3)═3v逆(H2)
C.N2、H2、NH3三种物质的反应速率之比为1:3:2
D.容器中总压强不随时间而变化
E.反应的△H不再变化
Ⅱ.高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的△H<0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡.求CO的平衡转化率=60%;欲提高(2)中CO的平衡转化率,可采取的措施是C(填序号).
(3)下列措施中能使平衡时$\frac{c(CO)}{c({CO}_{2})}$增大的是D(填序号).
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2 D.提高反应温度 E.减小容器的体积 F.加入合适的催化剂.
16.某有机物的结构简式如图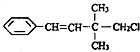 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
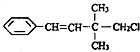 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )| A. | 一定条件下,能发生加聚反应 | |
| B. | 1mol该有机物在一定条件下最多能与4molH2发生反应 | |
| C. | 能使酸性KMnO4溶液、溴水褪色,且原理相同 | |
| D. | 该有机物苯环上的一溴代物有3种 |