题目内容
17.下列分别是实验室制取氨气的发生、净化、收集和吸收装置,其中正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.反应有水生成;
B.浓硫酸与氨气反应;
C.收集气体时不能密封;
D.氨气极易溶于水,球形结构可防止倒吸.
解答 解:A.反应有水生成,试管口应略向下倾斜,故A错误;
B.浓硫酸与氨气反应,不能干燥气体,故B错误;
C.收集气体时不能密封,图中装置不合理,故C错误;
D.氨气极易溶于水,球形结构可防止倒吸,图中收集装置合理,故D正确;
故选D.
点评 本题考查氨气的制备实验评价,为高频考点,把握实验装置的作用、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
8.骗子有时用铜锌合金制成假金币行骗.下列能有效鉴别其真假的是( )
| A. | 观察颜色 | B. | 滴一滴硝酸在币的表面,观察现象 | ||
| C. | 用手掂量轻重 | D. | 查看图案 |
12.下列说法正确的是( )
| A. | 0.1mol•L-1的NaCl溶液表示的是1L溶剂中溶解0.1mol NaCl的溶液 | |
| B. | 将0.1mol氧化钠溶于水并配成1L溶液,则溶液的物质的量浓度为0.1mol•L-1 | |
| C. | 物质的量浓度和溶质质量分数均是表示溶液组成的物理量 | |
| D. | 0.1mol•L-1的CaCl2溶液中c(Cl-)也为0.1mol•L-1 |
2.某气体可能含有NH3、HCl、CO、H2、CO2中的一种或几种,在恒温恒压下将其通过浓硫酸时,总体积基本不变;再通过足量的澄清石灰水,未见浑浊,但总体积减小;把剩余气体导出后点燃,燃烧产物不能使无水硫酸铜变蓝.则原气体中一定有( )
| A. | CO和HCl | B. | H2,HCl和CO | C. | CO2,CO和HCl | D. | CO2,CO |
9.反应A(g)+3B(g)?2C(g)+2D(g)分别从下列两条途径建立平衡:Ⅰ.A、B的起始物质的量分别为2mol和6mol;Ⅱ.C、D的起始物质的量均为2mol.在温度、压强恒定的条件下,以下叙述中不正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | 达平衡时,途径Ⅰ所得混合气体的密度为途径Ⅱ所得混合气体密度的$\frac{1}{2}$ | |
| C. | 达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A) | |
| D. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的平均相对分子质量相同 |
7.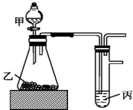 用如图装置进行实验,根据实验现象所得结论正确的是( )
用如图装置进行实验,根据实验现象所得结论正确的是( )
 用如图装置进行实验,根据实验现象所得结论正确的是( )
用如图装置进行实验,根据实验现象所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 漂白粉溶液 | 酸性:HCl>H2CO3>HClO |
| B | 盐酸 | 硫化亚铁 | 硫酸铜溶液 | 酸性:HCl>H2S>H2SO4 |
| C | 水 | 过氧化钠 | 水 | 过氧化钠与水的反应是放热反应 |
| D | 浓盐酸 | 二氧化锰 | 碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |