题目内容
15.(1)25℃、101kPa下,1g氢气燃烧生成气态水时放热Q kJ,此反应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-2QkJ•mol-1.(2)某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为 c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L,c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为4.
(3)有三种一元酸HA、HB、HC,相同物质的量浓度的NaC和NaB溶液的pH均大于7,前者比后者大,NaA溶液呈中性,则这三种酸的酸性由强到弱的顺序为HA>HB>HC.
分析 (1)计算出该条件下2g氢气完全燃烧放出的热量,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)根据溶液中阴阳离子所带电荷相等计算溶液中氢离子浓度,在根据pH的计算方法计算溶液的pH;
(3)酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大;强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,据此判断酸性强弱.
解答 解:(1)在25℃、101kPa下,1g氢气燃烧生成气态水时放热Q kJ,2g 氢气燃烧生成二氧化碳和液态水放出热量为:$\frac{2g}{1g}$×Q kJ=2QkJ,则该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-2QkJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-2QkJ•mol-1;
(2)溶液呈电中性,则溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)+2c(Ca2+)=2c(SO42-)+c(Cl-)+c(NO3-),即4×10-4mol/L+c(H+)+2×1.5×10-5 mol/L=2×2.5×10-4mol/L+1.6×10-5 mol/L+1.4×10-5 mol/L,所以c(H+)=1×10-4mol/L,所以溶液的pH=4,
故答案为:4;
(3)酸的酸性越强,酸根离子水解程度越小,相同浓度的钠盐溶液,酸根离子水解程度越大其钠盐溶液pH越大,相同物质的量浓度的NaC和NaB溶液的pH,前者比后者大,说明酸性强弱:HB>HC,且HB、HC都是弱酸;
强酸强碱盐溶液呈中性,强碱弱酸盐溶液呈碱性,NaA溶液呈中性,说明HA为强酸,所以这三种酸的酸性由强到弱的顺序为:HA>HB>HC,
故答案为:HA>HB>HC.
点评 本题考查了热化学方程式的书写、溶液pH的计算、酸性强弱比较等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确热化学方程式的书写原则,试题培养了学生的灵活应用能力.

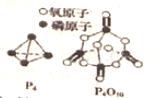 已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( )
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图所示,下表是部分化学键的键能数据,则表中x(用含有a、b、c、d的代数式表示)为( ) | 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | a | b | c | x |
| A. | 12b-d-6a-5c | B. | -(d+6a+5c-12b) | C. | d+6a+5c-12b | D. | d+6a.5c-12b |
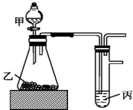 用如图装置进行实验,根据实验现象所得结论正确的是( )
用如图装置进行实验,根据实验现象所得结论正确的是( )| 甲 | 乙 | 丙 | 结论 | |
| A | 盐酸 | 石灰石 | 漂白粉溶液 | 酸性:HCl>H2CO3>HClO |
| B | 盐酸 | 硫化亚铁 | 硫酸铜溶液 | 酸性:HCl>H2S>H2SO4 |
| C | 水 | 过氧化钠 | 水 | 过氧化钠与水的反应是放热反应 |
| D | 浓盐酸 | 二氧化锰 | 碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | “无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 | |
| B. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 硫的氧化物和氮的氧化物是形成酸雨的主要物质 |

 .
.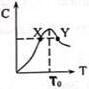 将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示: