9.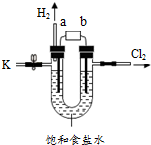 某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
资料:
1:电解饱和食盐水的化学方程式:
2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑
2:Cl2能溶于水.
探究活动一:确定电解饱和食盐水后的产物
(1)此电解原理与电解水原理类似,则a端为电源的负
极,甲组同学为了收集另一电极产生的气体,
他们用向上排空气法 法进行收集;
(2)甲组同学从K处取出一部分待测液,往里面加入
酚酞,发现溶液变红,说明电解后生成了氢氧化钠;
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取10g待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入溶质质量分数为19.6%的稀硫酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
(3)写出氢氧化钠与稀硫酸反应的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O;
(4)当加入6g稀硫酸时,溶液中溶质为氢氧化钠、硫酸钠,利用氢氧化钠与稀硫酸恰好完全反应时的实验数据,计算待测液中氢氧化钠的质量分数为16%;
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:

(5)步骤 ②加入的氯化镁溶液必须足量,其目的是使氢氧化钠完全反应;滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取少量反应后的待测溶液,滴加氢氧化钠;产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论);
(6)步骤 ③过滤出的沉淀物是氢氧化镁(填物质的名称);
(7)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所
测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.
某学习小组在老师的指导下,用自制的实验装置(如图所示)进行电解饱和食盐水的实验.资料:
1:电解饱和食盐水的化学方程式:
2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑
2:Cl2能溶于水.
探究活动一:确定电解饱和食盐水后的产物
(1)此电解原理与电解水原理类似,则a端为电源的负
极,甲组同学为了收集另一电极产生的气体,
他们用向上排空气法 法进行收集;
(2)甲组同学从K处取出一部分待测液,往里面加入
酚酞,发现溶液变红,说明电解后生成了氢氧化钠;
探究活动二:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取10g待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入溶质质量分数为19.6%的稀硫酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
| 加入稀硫酸的质量/g | 0 | 4.0 | 6.0 | 8.0 | 10.0 | 12.0 |
| 烧杯中溶液的pH | 13.0 | 12.8 | 12.5 | 12.3 | 7.0 | 1.3 |
(4)当加入6g稀硫酸时,溶液中溶质为氢氧化钠、硫酸钠,利用氢氧化钠与稀硫酸恰好完全反应时的实验数据,计算待测液中氢氧化钠的质量分数为16%;
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:

(5)步骤 ②加入的氯化镁溶液必须足量,其目的是使氢氧化钠完全反应;滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取少量反应后的待测溶液,滴加氢氧化钠;产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论);
(6)步骤 ③过滤出的沉淀物是氢氧化镁(填物质的名称);
(7)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所
测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
8.物质的用途与性质密切相关,下列说法不正确的是( )
| A. | 氧气常用于气焊,是因为氧气具有助燃性 | |
| B. | 氮气常用来制硝酸,是因为氮气具有稳定性 | |
| C. | 活性炭常用来除去色素和异味,是因为其具有吸附性 | |
| D. | C、CO、H2常用来冶炼金属,是因为它们都具有还原性 |
7.小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签已破损,从残余部分只能看出溶质质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠中的一种.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是常温下不可能得到质量分数为10%的氢氧化钙溶液.
(2)小亮取少量样品于一只洁净的试管中,向其中滴加无色酚酞溶液后,溶液变为红色,该溶液不可能是NaCl(填写化学式).
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
【设计实验】方案甲:选择氯化钙溶液来确定该溶液的成份;
方案乙:选择稀盐酸来确定该溶液的成份.
【进行实验】请你从方案甲和方案乙中选择一种方案进行实验.
【实验反思】有同学认为还可以用一种常见的碱溶液来确定,那么它是Ca(OH)2溶液(填化学式).
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是常温下不可能得到质量分数为10%的氢氧化钙溶液.
(2)小亮取少量样品于一只洁净的试管中,向其中滴加无色酚酞溶液后,溶液变为红色,该溶液不可能是NaCl(填写化学式).
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
【设计实验】方案甲:选择氯化钙溶液来确定该溶液的成份;
方案乙:选择稀盐酸来确定该溶液的成份.
【进行实验】请你从方案甲和方案乙中选择一种方案进行实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加氯化钙溶液或稀盐酸. | 有沉淀产生或有气泡产生 | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3═CaCO3↓+2NaCl或Na2CO3+2HCl═2NaCl+H2O+CO2↑. |
6.以下列举的连云港特产中,主要成分(水除外)属于无机化合物的是( )
| A. | 汪恕有滴醋;主要成分:醋酸 | B. | 汤沟酒;主要成分:乙醇 | ||
| C. | 贝雕;主要成分:碳酸钙 | D. | 葛藤粉;主要成分:淀粉 |
5.小京同学今天的午餐食谱是:主食--面包;配菜和副食--炸鸡腿、炸薯片、牛排、奶酪.小京午餐缺乏的营养素是( )
0 165312 165320 165326 165330 165336 165338 165342 165348 165350 165356 165362 165366 165368 165372 165378 165380 165386 165390 165392 165396 165398 165402 165404 165406 165407 165408 165410 165411 165412 165414 165416 165420 165422 165426 165428 165432 165438 165440 165446 165450 165452 165456 165462 165468 165470 165476 165480 165482 165488 165492 165498 165506 211419
| A. | 糖类 | B. | 脂肪 | C. | 蛋白质 | D. | 维生素 |
