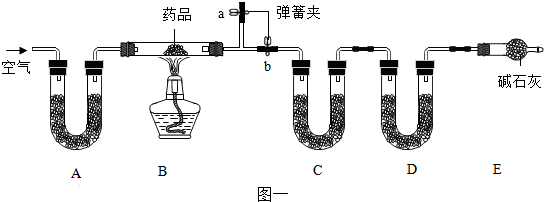
2.下列变化中,前者是物理变化,后者是化学变化的是( )
| A. | 冰雪融化 食物腐烂 | B. | 牛奶变酸 铁生锈 | ||
| C. | 水的电解 纸张燃烧 | D. | 酒精挥发 工业上制氧气 |
1.如图所示实验操作中,错误的是( )
| A. |  量取液体 | B. |  浓硫酸稀释 浓硫酸稀释 | C. |  CO2的验满 | D. |  液体的倾倒 |
20.推理是化学学习常用的方法,请根据反应事实写出的影响化学反应的因素.
| 序号 | 化学反应事实 | 影响化学反应的因素 |
| ① | 铁丝在空气中很难燃烧,若在氧气中能剧烈燃烧 | 氧气的浓度 |
| ② | 化油器将汽油喷成雾状,进入内燃机气缸燃烧剧烈 | 反应物的接触面积 |
| ③ | 双氧水在常温下较难分解,若加入二氧化锰后迅速分解 | 催化剂 |
| ④ | CO2与水反应生成碳酸,若参与植物光合作用则生成葡萄糖 | 反应的条件 |
18.铁、铝、铜是常见的三种金属.同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理.
(一)提出问题:这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
(二)实验探究:同学们对这三种金属的活动性顺序展开探究,请填写下列空格.
将粗细相同的铁丝、铝丝、铜丝分别插入质量相同、溶质质量分数也相同的稀盐酸中:
(三)讨论交流:为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了资料,明白了铝丝在稀盐酸中短时间无气泡,是因为铝表面致密的氧化膜会先与盐酸反应.
(四)反思评价:做金属性质实验时需将金属进行打磨,打磨的目的是除去金属表面的氧化物(或污物).
(五)实验验证:为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
写出铁与硫酸铜溶液反应的化学方程式Fe+CuSO4=FeSO4+Cu.
(六)拓展迁移:
(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.金属丝的插入顺序为Cu、Fe、Al.
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关.请写出铁、铝、铜三种金属材料中被人类利用较晚的金属是Al.
(3)同学们在实验室发现了一块铜片生锈了,表面附有部分铜绿(铜绿的主要成分是Cu2(OH)2CO3),推测铜绿是铜与空气中的氧气、水和二氧化碳共同作用的结果.
(一)提出问题:这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
(二)实验探究:同学们对这三种金属的活动性顺序展开探究,请填写下列空格.
将粗细相同的铁丝、铝丝、铜丝分别插入质量相同、溶质质量分数也相同的稀盐酸中:
| 操作 |  |  |  | 根据现象得出 金属活动性顺序 |
| 片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
| 几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 | Al>Fe>Cu |
(四)反思评价:做金属性质实验时需将金属进行打磨,打磨的目的是除去金属表面的氧化物(或污物).
(五)实验验证:为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
| 操 作 |  |  | 根据现象得出 金属活动性顺序 |
| 现 象 | 无明显现象 | 铁丝表面有红色物质析出 | Al>Fe>Cu |
(六)拓展迁移:
(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序.金属丝的插入顺序为Cu、Fe、Al.
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关.请写出铁、铝、铜三种金属材料中被人类利用较晚的金属是Al.
(3)同学们在实验室发现了一块铜片生锈了,表面附有部分铜绿(铜绿的主要成分是Cu2(OH)2CO3),推测铜绿是铜与空气中的氧气、水和二氧化碳共同作用的结果.
17.下列有关物质燃烧现象的叙述中,正确的是( )
| A. | 铁丝在氧气中燃烧:火星四射,生成一种黑色固体 | |
| B. | 木炭在空气中燃烧:生成一种黑色固体 | |
| C. | 红磷在空气中燃烧:产生黄色火焰,生成大量的白色烟雾 | |
| D. | 硫粉在氧气中燃烧:产生淡蓝色火焰,生成一种刺激性气味的气体 |
16.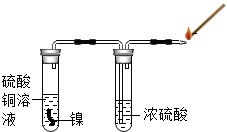 某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.
某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.
探究活动一、金属镍和铜的活动性顺序
若在生成物中Ni为+2价,则该反应的化学方程式为Ni+CuSO4=NiSO4+Cu.
实验过程中,小组同学还发现试管中有无色气体产生的“异常”现象,十分好奇,于是继续进行探究活动.
探究活动二、无色气体的成分是什么?
【猜想假设】A.氢气 B.氧气 C.二氧化硫 D.二氧化碳 E.一氧化碳
【分析推理】小明认为无色气体不可能是二氧化碳或一氧化碳,理由是反应物中不含碳元素,化学反应前后元素种类不变.
小红根据二氧化硫能够形成酸雨的事实,推测二氧化硫能溶于水,且水溶液应该呈酸性能使指示剂变色小组同学认为小红的观点合理,于是将收集到到气体收入紫色石蕊溶液溶液中,发现溶液不变色,证明无色气体不是二氧化硫.
综上所述,小组同学认为,无色气体可能是氢气,或者氧气.
【设计方案】为确定气体成分,小组同学设计了如下实验方案:
用如图所示装置进行实验,先检验气体纯度,然后将燃着的木条放在尖嘴处,发现气体燃烧并发出淡蓝色火焰,证明无色气体可能是氢气.
该实验方案中浓硫酸的作用是除去气体中的水分.
【评价与反应】小组同学认为,还可以补充一个实验,验证无色气体中含有氢元素,从而进一步证明无色气体可能是氢气.他们应补充的实验是在点燃气体的火焰上方罩一个干冷的烧杯,烧杯内壁产生水珠.
 某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.
某研究性学习小组的同学为探究金属镍(Ni,银白色金属)和铜的活动性顺序,进行了一系列实验活动.请你一起参与他们的活动,并回答有关问题.探究活动一、金属镍和铜的活动性顺序
| 实验方案 | 实验现象 | 实验结论 |
| 将金属镍加入到盛有硫酸铜溶液的试管中 | 溶液的颜色变浅,有红色固体析出 | 镍比铜的金属活动性强 |
实验过程中,小组同学还发现试管中有无色气体产生的“异常”现象,十分好奇,于是继续进行探究活动.
探究活动二、无色气体的成分是什么?
【猜想假设】A.氢气 B.氧气 C.二氧化硫 D.二氧化碳 E.一氧化碳
【分析推理】小明认为无色气体不可能是二氧化碳或一氧化碳,理由是反应物中不含碳元素,化学反应前后元素种类不变.
小红根据二氧化硫能够形成酸雨的事实,推测二氧化硫能溶于水,且水溶液应该呈酸性能使指示剂变色小组同学认为小红的观点合理,于是将收集到到气体收入紫色石蕊溶液溶液中,发现溶液不变色,证明无色气体不是二氧化硫.
综上所述,小组同学认为,无色气体可能是氢气,或者氧气.
【设计方案】为确定气体成分,小组同学设计了如下实验方案:
用如图所示装置进行实验,先检验气体纯度,然后将燃着的木条放在尖嘴处,发现气体燃烧并发出淡蓝色火焰,证明无色气体可能是氢气.
该实验方案中浓硫酸的作用是除去气体中的水分.
【评价与反应】小组同学认为,还可以补充一个实验,验证无色气体中含有氢元素,从而进一步证明无色气体可能是氢气.他们应补充的实验是在点燃气体的火焰上方罩一个干冷的烧杯,烧杯内壁产生水珠.
15.有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种.为探究其成分,小燕老师取用一定量样品,加足量水溶解,过滤得到白色沉淀甲和无色滤液乙.
写出上述操作中可能发生的反应的化学方程式BaCl2+Na2CO3═BaCO3↓+2NaCl
过滤时用到玻璃棒,玻璃棒的作用是引流.
【探究活动一】奋进小组探究白色沉淀甲的成分.
【探究活动二】智慧小组探究白色固体样品中可能含有氢氧化钠,设计了如下实验.
【反思】实验Ⅱ中步骤①加入过量试剂的目的是除去碳酸钠.
【结论】通过两个小组的共同探究,得出了原白色固体样品含有的成分.
写出上述操作中可能发生的反应的化学方程式BaCl2+Na2CO3═BaCO3↓+2NaCl
过滤时用到玻璃棒,玻璃棒的作用是引流.
【探究活动一】奋进小组探究白色沉淀甲的成分.
| 实验操作 | 实验现象 | 结论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有硫酸钡和碳酸钡 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含氯化钡 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的氯化钡溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加无色酚酞溶液 | 无色酚酞溶液变红色 | ||
【结论】通过两个小组的共同探究,得出了原白色固体样品含有的成分.
13.实验室中的药品一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组的同学对实验室里久置于空气中已变质的过氧化钠(Na2O2)固体的成分进行探究.
【查阅资料】(1)Na2O2的化学性质很活泼,能与H2O、CO2反应,相关反应的化学方程式为:
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
(2)CaCl2溶液为中性
【猜想】Ⅰ:固体为Na2O2、NaOH、Na2CO3的混合物
II:固体为NaOH和Na2CO3的混合物
III:固体为NaOH
IV:固体为Na2CO3
【实验探究】
【反思评价】
(1)实验操作②中反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl
(2)实验操作②中“滴加CaCl2溶液至过量”的目的是除去溶液中的Na2CO3,防止干扰NaOH的鉴定.
0 150104 150112 150118 150122 150128 150130 150134 150140 150142 150148 150154 150158 150160 150164 150170 150172 150178 150182 150184 150188 150190 150194 150196 150198 150199 150200 150202 150203 150204 150206 150208 150212 150214 150218 150220 150224 150230 150232 150238 150242 150244 150248 150254 150260 150262 150268 150272 150274 150280 150284 150290 150298 211419
【查阅资料】(1)Na2O2的化学性质很活泼,能与H2O、CO2反应,相关反应的化学方程式为:
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
(2)CaCl2溶液为中性
【猜想】Ⅰ:固体为Na2O2、NaOH、Na2CO3的混合物
II:固体为NaOH和Na2CO3的混合物
III:固体为NaOH
IV:固体为Na2CO3
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体于试管中,加振荡,直至完全溶解 | 猜想Ⅰ不成立 | |
| ②取少量①的溶液于试管中,滴加CaCl2溶液至过量 | 证明有Na2CO3存在 | |
| ③取少量②的溶液于试管中,滴加几滴酚酞试液,震荡. | 证明有NaOH存在 | |
| 综合以上实验现象,说明猜想II是成立的. | ||
(1)实验操作②中反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl
(2)实验操作②中“滴加CaCl2溶液至过量”的目的是除去溶液中的Na2CO3,防止干扰NaOH的鉴定.
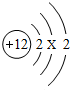 将宏观、微观及化学符号联系在一起是化学学科的特点.
将宏观、微观及化学符号联系在一起是化学学科的特点.