19.下列变化中,属于化学变化的是( )
| A. |  对干燥的玻璃片哈气 | B. |  用合金在纯金属上刻画 | ||
| C. |  燃放礼花 | D. |  活性碳吸附毒气 |
16.“元旦”假期,某化学兴趣小组探究“排水法收集氧气时机的选择”,用加热高锰酸钾进行相关实验.
(1)写出加热高锰酸钾反应的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(2)用排水法收集氧气时要等到“气泡连续,均匀冒出”才开始收集,原因是一开始的气泡中含有较多的空气.
【提出问题】“气泡连续,均匀冒出,此时排出的氧气比较纯净”,事实如此吗?
【设计并实验】采用高锰酸钾加热分解产生氧气,测定不同时刻从试管排出的气体中氧气的浓度.
(3)在加热药品的第①时段后期(11-16s),气泡已经连续、均匀且快速冒出,此时排出气体中氧气的浓度最大只有28.7%左右.
(4)“气泡连续,均匀冒出时表示排出的氧气已经比较纯净”的说法是不合理(填“合理”或“不合理”)的.
【查阅资料】对于初中氧气性质实验而言,氧气浓度只需达到一定的数值,即满足实验要求即可.
【实验探究】
①取一个氧气瓶,使瓶内留有占集气瓶40%的水(余下的为空气),用玻璃片盖住,并倒扣于装有水的水槽中.
②用排水法收集氧气,小心地把瓶内的水排完用玻璃片盖住瓶口,取出立正放好.
③带火星木条伸入集气瓶中,带火星木条复燃.
【反思与交流】
(5)通过实验探究,发现使带火星木条复燃的氧气不一定(填“不一定”或“一定”)是纯氧.
(6)集气瓶中氧气的体积分数=收集的氧气占容积的体积分数+瓶中空气占容积的体积分数×21%.
(7)理论上,上述实验“使带火星的木条复燃”的氧气体积分数是52.6%(计算结果保留一位小数)该兴趣小组利用不同时机收集的氧气(其中有1瓶预留少量的水)进行试验,发生反应的实验现象如下
(8)实验表明,排水法收集氧气时最适宜的时机是加热到35s左右,根据上表中实验现象分析你得出结论的原因:时机3收集的氧气进行的四个实验效果均很理想.
(1)写出加热高锰酸钾反应的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(2)用排水法收集氧气时要等到“气泡连续,均匀冒出”才开始收集,原因是一开始的气泡中含有较多的空气.
【提出问题】“气泡连续,均匀冒出,此时排出的氧气比较纯净”,事实如此吗?
【设计并实验】采用高锰酸钾加热分解产生氧气,测定不同时刻从试管排出的气体中氧气的浓度.
| 时段 | 氧气浓度变化特点 | 氧气浓度变化范围 | 加热时间 | 气泡特征 |
| ① | 逐渐增大 | 21.2%-28.7% | 1-11s | 不持续、不均匀 |
| 11-16s | 持续、均匀、快速 | |||
| ② | 快速增大 | 28.8%-66.7% | 16-34s | |
| ③ | 逐渐变暖 | 66.7%-86.3% | 34-80s | |
| ④ | 趋于稳定 | 86.3%-88.7% | 80s-135 |
(4)“气泡连续,均匀冒出时表示排出的氧气已经比较纯净”的说法是不合理(填“合理”或“不合理”)的.
【查阅资料】对于初中氧气性质实验而言,氧气浓度只需达到一定的数值,即满足实验要求即可.
【实验探究】
①取一个氧气瓶,使瓶内留有占集气瓶40%的水(余下的为空气),用玻璃片盖住,并倒扣于装有水的水槽中.
②用排水法收集氧气,小心地把瓶内的水排完用玻璃片盖住瓶口,取出立正放好.
③带火星木条伸入集气瓶中,带火星木条复燃.
【反思与交流】
(5)通过实验探究,发现使带火星木条复燃的氧气不一定(填“不一定”或“一定”)是纯氧.
(6)集气瓶中氧气的体积分数=收集的氧气占容积的体积分数+瓶中空气占容积的体积分数×21%.
(7)理论上,上述实验“使带火星的木条复燃”的氧气体积分数是52.6%(计算结果保留一位小数)该兴趣小组利用不同时机收集的氧气(其中有1瓶预留少量的水)进行试验,发生反应的实验现象如下
| 时机1(加热10s) | 时机2(加热15s) | 时机3(加热35s) | |
| 带火星木条 | 复燃 | 复燃 | 复燃 |
| 木炭燃烧 | 木炭变红 | 燃烧,红光 | 剧烈燃烧,白光 |
| 蜡烛燃烧 | 燃烧更旺,红光 | 燃烧更旺,白光 | 燃烧更旺,白光 |
| 铁丝燃烧 | 铁丝熔成红色小球,有火花产生(红光) | 燃烧,火星四溅,有少量黑色固体生成 | 燃烧,火星四溅,有较多黑色固体生成 |
15.实验室有一瓶标签模糊的氢氧化钠溶液,为了测定其溶质质量分数,小明进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;
②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量.数据如下表:
回答下列问题:
(1)若要配制100g 7.3%的盐酸,需要1.1g/cm3 20%的盐酸33.2mL.
(2)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数.(写出计算过程)
(3)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度偏大(选填“偏大”或“偏小”),造成这一偏差的原因是反应后的溶液显酸性,溶液变无色时,滴加盐酸的已过量.
①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;
②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量.数据如下表:
| 锥形瓶/g | 锥形瓶+氢氧化钠溶液/g | 锥形瓶+反应后溶液/g | |
| 质量/g | 35.5 | 60.5 | 110.5 |
(1)若要配制100g 7.3%的盐酸,需要1.1g/cm3 20%的盐酸33.2mL.
(2)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数.(写出计算过程)
(3)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度偏大(选填“偏大”或“偏小”),造成这一偏差的原因是反应后的溶液显酸性,溶液变无色时,滴加盐酸的已过量.
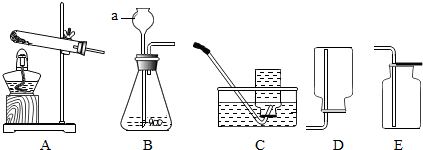
13.【实验一】结合下列实验装置图回答问题

(1)用A图制取二氧化碳气体,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,若锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭,则是由于A装置存在缺陷,其缺陷为长颈漏斗未伸入液面,造成气体逸出;
(2)图B、C、D是探究二氧化碳化学性质的实验,C中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O,,证明二氧化碳与氢氧化钠溶液发生反应的现象是C中有白色沉淀生成;
(3)图E和F是探究哪种离子能促进H2O2分解的实验,现象是:E中产生大量气泡,F中没有明显现象,则促进H2O2分解的离子符号是Fe3+.
【实验二】探究燃烧的条件
实验:下图的装置可用于探究燃烧的条件

现象:①不通氧气时,A中白磷不燃烧
②不通氧气时,B中白磷不燃烧
③通氧气时,A中白磷不燃烧
④通氧气时,B中白磷燃烧
(1)证明可燃物燃烧,温度必须达到着火点的现象是③④(填序号);
(2)A、B组合与C装置相比的优点是C装置在密闭环境中进行,避免了P2O5对空气的污染.
【实验三】老师在课堂上说:“氢氧化钡与氢氧化钙化学性质相似”.化学兴趣小组的同学决定用氢氧化钡溶液来进行验证,他们做了以下实验.
结论:氢氧化钡的化学性质与氢氧化钙相似.
(1)写出实验三中发生反应的化学方程式Na2CO2+Ba(OH)2═BaCO3↓+2NaOH;
同学们将上述反应后的废液倒入烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究.
探究一:
【提出问题】沉淀能否与酸发生反应?
【实验探究】向沉淀中加入足量的稀硫酸,有气泡产生,白色固体不消失.
【实验结论】沉淀与酸不反应.
(2)有同学提出,根据“白色固体不消失”这一现象所得出的结论不严谨,理由是硫酸钡也是白色固体;
探究二:
【提出问题】滤液中除酚酞外,还有哪些溶质?
【作出猜想】Ⅰ.只有氢氧化钠Ⅱ.有氢氧化钠和碳酸钠Ⅲ.有氢氧化钠和氢氧化钡
【实验探究】
(3)有同学提出:实验四由于实验操作存在问题,导致结论不准确,该实验 操作上存在的问题是加入的稀盐酸的量太少,现象不明显;
【反思交流】
(4)小组同学经分析、讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是稀硫酸;
(5)在废液中滴加稀盐酸至红色消失(填写实验现象)时,表示废液已呈中性.
0 147449 147457 147463 147467 147473 147475 147479 147485 147487 147493 147499 147503 147505 147509 147515 147517 147523 147527 147529 147533 147535 147539 147541 147543 147544 147545 147547 147548 147549 147551 147553 147557 147559 147563 147565 147569 147575 147577 147583 147587 147589 147593 147599 147605 147607 147613 147617 147619 147625 147629 147635 147643 211419

(1)用A图制取二氧化碳气体,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O,若锥形瓶内的反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭,则是由于A装置存在缺陷,其缺陷为长颈漏斗未伸入液面,造成气体逸出;
(2)图B、C、D是探究二氧化碳化学性质的实验,C中发生反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O,,证明二氧化碳与氢氧化钠溶液发生反应的现象是C中有白色沉淀生成;
(3)图E和F是探究哪种离子能促进H2O2分解的实验,现象是:E中产生大量气泡,F中没有明显现象,则促进H2O2分解的离子符号是Fe3+.
【实验二】探究燃烧的条件
实验:下图的装置可用于探究燃烧的条件

现象:①不通氧气时,A中白磷不燃烧
②不通氧气时,B中白磷不燃烧
③通氧气时,A中白磷不燃烧
④通氧气时,B中白磷燃烧
(1)证明可燃物燃烧,温度必须达到着火点的现象是③④(填序号);
(2)A、B组合与C装置相比的优点是C装置在密闭环境中进行,避免了P2O5对空气的污染.
【实验三】老师在课堂上说:“氢氧化钡与氢氧化钙化学性质相似”.化学兴趣小组的同学决定用氢氧化钡溶液来进行验证,他们做了以下实验.
| 序 号 | 操 作 | 现 象 | 结 论 |
| 实验一 | 向氢氧化钡溶液中滴入酚酞 | 溶液变红 | 氢氧化钡溶液呈碱性 |
| 实验二 | 向实验一的溶液中通入 适量的二氧化碳 | 产生白色沉淀,红色消失 | 氢氧化钡溶液能与 二氧化碳反应 |
| 实验三 | 另取氢氧化钡溶液,滴入 一定量的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与 碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式Na2CO2+Ba(OH)2═BaCO3↓+2NaOH;
同学们将上述反应后的废液倒入烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究.
探究一:
【提出问题】沉淀能否与酸发生反应?
【实验探究】向沉淀中加入足量的稀硫酸,有气泡产生,白色固体不消失.
【实验结论】沉淀与酸不反应.
(2)有同学提出,根据“白色固体不消失”这一现象所得出的结论不严谨,理由是硫酸钡也是白色固体;
探究二:
【提出问题】滤液中除酚酞外,还有哪些溶质?
【作出猜想】Ⅰ.只有氢氧化钠Ⅱ.有氢氧化钠和碳酸钠Ⅲ.有氢氧化钠和氢氧化钡
【实验探究】
| 序号 | 操作 | 现象 | 结论 |
| 实验四 | 取滤液样品于试管中, 加入几滴稀盐酸 | 没有明显现象 | 猜想Ⅱ不成立 |
| 实验五 | 取滤液样品于试管中, 加入几滴碳酸钠溶液 | 有白色沉淀产生,红色不消失 | 猜想Ⅲ成立 |
【反思交流】
(4)小组同学经分析、讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是稀硫酸;
(5)在废液中滴加稀盐酸至红色消失(填写实验现象)时,表示废液已呈中性.


 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答: