题目内容
10.如图为实验室常用的制取和收集气体的装置,请回答下列问题.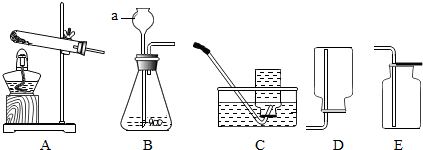
(1)仪器a的名称是长颈漏斗.
(2)实验室选择装置A且用高锰酸钾制取氧气时:
①你认为A装置存在的问题是试管口无棉花;
②该反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
③若选用C做收集装置时,实验结束,停止加热前一定要先将导管移出水面,目的是防止水倒流入试管,把试管炸裂.
(3)实验室可用选择装置BE(填序号)制取并收集CO2气体,该反应的化学方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O.
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)据高锰酸钾制取氧气的原理、为了防止水蒸气冷凝、回流炸裂试管,试管口应该略向下倾斜;为了防止高锰酸钾进入导管,通常在试管口塞一团棉花解答;
(3)据二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取.
解答 解:(1)a是长颈漏斗.故填:长颈漏斗;
(2)①高锰酸钾制取氧气,试管口要放棉花团防止高锰酸钾进入导管;
②实验室用高锰酸钾制取氧气,同时生成锰酸钾、二氧化锰,反应的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
③实验结束停止加热时,要先把导管移出水面,其理由是:防止水倒流入试管,把试管炸裂;
故填:①试管口无棉花;②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;③防止水倒流入试管,把试管炸裂.
(3)二氧化碳的实验室制法是用稀盐酸与大理石(或石灰石.其主要成分都是碳酸钙)反应来制取.其反应原理是CaCO3+2HCl=CaCl2+CO2↑+H2O.反应不需加热,发生装置选择B,二氧化碳密度比空气大,能溶于水,收集装置选择E.
故填:BE、CaCO3+2HCl=CaCl2+CO2↑+H2O
点评 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.

练习册系列答案
相关题目
18.科学可以指导生活,下列说法或做法不合理的是( )
| A. | 油锅着火时应立即盖上锅盖 | B. | 电器火灾可用泡沫灭火器灭火 | ||
| C. | C暖水瓶中薄层水垢用食醋去除 | D. | 冰箱中的异味可用活性炭去除 |
15.实验室有一瓶标签模糊的氢氧化钠溶液,为了测定其溶质质量分数,小明进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;
②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量.数据如下表:
回答下列问题:
(1)若要配制100g 7.3%的盐酸,需要1.1g/cm3 20%的盐酸33.2mL.
(2)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数.(写出计算过程)
(3)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度偏大(选填“偏大”或“偏小”),造成这一偏差的原因是反应后的溶液显酸性,溶液变无色时,滴加盐酸的已过量.
①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;
②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量.数据如下表:
| 锥形瓶/g | 锥形瓶+氢氧化钠溶液/g | 锥形瓶+反应后溶液/g | |
| 质量/g | 35.5 | 60.5 | 110.5 |
(1)若要配制100g 7.3%的盐酸,需要1.1g/cm3 20%的盐酸33.2mL.
(2)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数.(写出计算过程)
(3)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度偏大(选填“偏大”或“偏小”),造成这一偏差的原因是反应后的溶液显酸性,溶液变无色时,滴加盐酸的已过量.
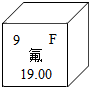 含氟物质的合成,对推动社会进步发挥着巨大作用.
含氟物质的合成,对推动社会进步发挥着巨大作用.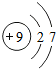 ,由氟原子的结构示意图知,氟原子在化学反应中易得(选填“失”或“得”)电子.
,由氟原子的结构示意图知,氟原子在化学反应中易得(选填“失”或“得”)电子.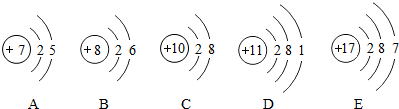
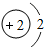 ,上图中与其化学性质相似的元素是C(填序号).
,上图中与其化学性质相似的元素是C(填序号).