题目内容
11. 酸、碱、盐在生活中应用广泛.请根据图示回答相关问题:
酸、碱、盐在生活中应用广泛.请根据图示回答相关问题:(1)从微观角度看物质的变化是化学的思维方式之一.如图表示生成氯化钠的化学反应,该反应的化学方程式是NaOH+HCl=NaCl+H2O,其微观实质是OH-与H+结合生成H2O分子.
(2)对比学习有利于发现事物的共性与个性.为探究酸的化学性质,某同学进行了如下实验.
| 实验内容 |  |  |  |
| 实验现象 | A试管内无明显现象,B试管中镁带表面观察到的现象是有气泡产生或冒气泡. | C、D两试管中均观察到有气泡产生. | E试管中观察到的现象是 产生白色沉淀; F试管中无明显现象. |
| 结论 | 酸的很多反应通常在水溶液中才能完成. | 酸具有相似的化学性质或酸能与碳酸盐反应生成CO2 | 不同的酸根会导致酸的“个性”有差异. |
清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀.废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为Na2SO4+BaCl2=2NaCl+BaSO4↓,白色沉淀中可能还含有BaCO3(填化学式).
分析 (1)根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.由图中可知,反应前后氯离子和钠离子实际上没有参加反应,所以酸碱中和反应的实质是氢离子和氢氧根离子结合生成水.
(2)根据镁与酸反应生成氢气来分析;根据酸的通性来分析;根据实验现象来分析解答.
解答 解:(1)由图中可知,氢氧化钠溶液和盐酸反应生成氯化钠和水,由图中可知,氯离子和钠离子实际上没有参加反应,中和反应的实质是氢离子和氢氧根离子结合生成水,故填:NaOH+HCl=NaCl+H2O;OH-与H+结合生成 H2O分子;
(2)镁与醋酸反应生成氢气,故看到的实验现象:有气泡产生或冒气泡;故填:有气泡产生或冒气泡;
无论是稀盐酸还是稀硫酸均能与碳酸钠反应产生二氧化碳气体,说明了酸具有的通性,故填:酸具有相似的化学性质或酸能与碳酸盐反应生成CO2;
C中的硫酸钠能与F中的氯化钡溶液反应生成氯化钠和硫酸钡白色沉淀;若C中碳酸钠过量,碳酸钠还能与氯化钡溶液反应生成碳酸钡白色沉淀;故填:Na2SO4+BaCl2=2NaCl+BaSO4↓;BaCO3.
点评 解答本题的关键是要掌握化学方程式的书写方法和酸碱中和反应的实质以及酸的性质等,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目
1.下列鉴别方法不能把待鉴别的物质区分开的是( )
| 待鉴别的物质 | 鉴别方法 | |
| A | 硬水和软水 | 加肥皂水 |
| B | 硫酸铵溶液和硝酸钾溶液 | 加氯化钡溶液 |
| C | 合成纤维和纯棉面料 | 抽丝点燃闻是否有烧焦毛发的气味 |
| D | 氢氧化钠溶液和碳酸钠溶液 | 加无色酚酞试液 |
| A. | A | B. | B | C. | C | D. | D |
6.小丽在研究酸碱的中和反应时,将稀盐酸倒入到滴有酚酞的氢氧化钠溶液中,结果看到溶液变成无色,她认为酸碱之间发生了反应且得到的溶液呈中性.
(1)反应前滴有酚酞的溶液呈红色,pH>7.
(2)对反应后溶液的酸碱性,同学们提出质疑,猜想还可能成酸性.
(3)请你设计实验方案证明同学们的猜想:
(1)反应前滴有酚酞的溶液呈红色,pH>7.
(2)对反应后溶液的酸碱性,同学们提出质疑,猜想还可能成酸性.
(3)请你设计实验方案证明同学们的猜想:
| 实验步骤 | 实验现象 | 实验结论 |
| ①用试管取少量反应后的溶液,加入锌粒(其它合理即可) | ②有气泡产生(对应合理即可) | 猜想正确 |
16.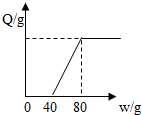 向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
 向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )| A. | 14.2% | B. | 7.1% | C. | 3.55% | D. | 10% |
20.下列图象与对应选项关系合理的是( )
| A. | 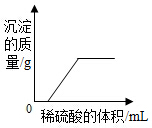 向氯化钡和氢氧化钠的混合溶液中滴加稀硫酸 | |
| B. |  用相同质量的氯酸钾固体加热分解来制取氧气 | |
| C. | 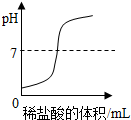 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. |  向一定质量一定质量分数的稀盐酸中加入铁粉 |
1.下列除去杂质(括号内)的方法正确的是( )
| A. | N2中的(O2):红热的木炭 | B. | CaO (CaCO3):加适量稀盐酸 | ||
| C. | NaCl溶液(盐酸):加热蒸发 | D. | 铁粉(铜粉):加入足量稀硫酸 |
 4月6日,福建古雷石化(PX项目)厂区发生爆炸,经过消防官兵几天的奋战,成功扑灭大火.PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,是一种低毒化合物,请回答:
4月6日,福建古雷石化(PX项目)厂区发生爆炸,经过消防官兵几天的奋战,成功扑灭大火.PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,是一种低毒化合物,请回答: 某化学兴趣小组利用废旧干电池回收原料中的二氧化锰和氯化铵查阅资料:废旧干电池的填料的主要成分为二氧化锰氯化铵氯化锌等,其中氯化氨氯化锌可溶于水.兴趣小组同学们我,设计回收物质的流程如图所示:
某化学兴趣小组利用废旧干电池回收原料中的二氧化锰和氯化铵查阅资料:废旧干电池的填料的主要成分为二氧化锰氯化铵氯化锌等,其中氯化氨氯化锌可溶于水.兴趣小组同学们我,设计回收物质的流程如图所示: