题目内容
20.下列图象与对应选项关系合理的是( )| A. | 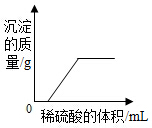 向氯化钡和氢氧化钠的混合溶液中滴加稀硫酸 | |
| B. |  用相同质量的氯酸钾固体加热分解来制取氧气 | |
| C. | 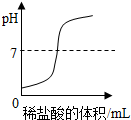 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. |  向一定质量一定质量分数的稀盐酸中加入铁粉 |
分析 A、根据钡离子和硫酸根离子接触就会生成硫酸钡沉淀进行分析;
B、根据催化剂只会改变反应的速率,不会影响生成氧气的质量进行分析;
C、根据氢氧化钠的溶液的pH值小于7进行分析;
D、根据铁和盐酸反应生成氯化亚铁和氢气进行分析.
解答 解:A、钡离子和硫酸根离子接触就会生成硫酸钡沉淀,所以生成沉淀应该从零开始,故A错误;
B、催化剂只会改变反应的速率,不会影响生成氧气的质量,故B错误;
C、氢氧化钠的溶液的pH值小于7,而图中的pH值是从小于7开始的,故C错误;
D、铁和盐酸反应生成氯化亚铁和氢气,一开始溶液中没有铁元素,反应后逐渐增加,然后不变,故D正确.
故选:D.
点评 根据所给的问题情景及相关信息,结合所学的相关知识和技能,联系起来细心地探究、推理后,按照题目要求进行选择或解答即可.

练习册系列答案
相关题目
10.KNO3、NaNO3等硝酸盐中氮元素的化合价为( )
| A. | -1 | B. | 0 | C. | +3 | D. | +5 |
11. 酸、碱、盐在生活中应用广泛.请根据图示回答相关问题:
酸、碱、盐在生活中应用广泛.请根据图示回答相关问题:
(1)从微观角度看物质的变化是化学的思维方式之一.如图表示生成氯化钠的化学反应,该反应的化学方程式是NaOH+HCl=NaCl+H2O,其微观实质是OH-与H+结合生成H2O分子.
(2)对比学习有利于发现事物的共性与个性.为探究酸的化学性质,某同学进行了如下实验.
请分析上述现象并回答:
清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀.废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为Na2SO4+BaCl2=2NaCl+BaSO4↓,白色沉淀中可能还含有BaCO3(填化学式).
 酸、碱、盐在生活中应用广泛.请根据图示回答相关问题:
酸、碱、盐在生活中应用广泛.请根据图示回答相关问题:(1)从微观角度看物质的变化是化学的思维方式之一.如图表示生成氯化钠的化学反应,该反应的化学方程式是NaOH+HCl=NaCl+H2O,其微观实质是OH-与H+结合生成H2O分子.
(2)对比学习有利于发现事物的共性与个性.为探究酸的化学性质,某同学进行了如下实验.
| 实验内容 |  |  |  |
| 实验现象 | A试管内无明显现象,B试管中镁带表面观察到的现象是有气泡产生或冒气泡. | C、D两试管中均观察到有气泡产生. | E试管中观察到的现象是 产生白色沉淀; F试管中无明显现象. |
| 结论 | 酸的很多反应通常在水溶液中才能完成. | 酸具有相似的化学性质或酸能与碳酸盐反应生成CO2 | 不同的酸根会导致酸的“个性”有差异. |
清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀.废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为Na2SO4+BaCl2=2NaCl+BaSO4↓,白色沉淀中可能还含有BaCO3(填化学式).
8.取镁、碳酸镁组成的固体混合物20.4g,放入325g稀硫酸中,恰好完全反应,得到5.4g气体和溶质质量分数为20%的溶液,则原固体混合物中镁元素的质量为( )
| A. | 4.8g | B. | 9.6g | C. | 13.6g | D. | 16.8g |
15.下表中列出了除去物质中所含少量杂质的方法其中错误的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO | CO2 | 通过足量氢氧化钠溶液,用浓硫酸干燥 |
| B | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| C | N2 | O2 | 通过足量的灼热铜闸 |
| D | NaOH溶液 | Na2CO3 | 加适量AgNO3溶液、过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.以下属于人体必需微量元素的是( )
| A. | 氢 | B. | 锌 | C. | 钙 | D. | 氧 |
9.实验室配制100g 6%的氯化钠溶液,有关实验操作不正确的是( )
| A. | 用托盘天平称取6.0g氯化钠 | |
| B. | 用量筒量取94.0mL的水 | |
| C. | 将称取的氯化钠倒入量筒中溶解 | |
| D. | 将配制的溶液装入试剂瓶中,贴上标签 |