题目内容
5.据图回答问题:
(1)实验室中用B和C组合可制取的气体是O2或H2(填化学式).
(2)常温下氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,NH3极易溶于水,可用加热氯化铵和氢氧化钙的固体混合物制取,如果要制取并收集氨气应选择的装置是AD.
(3)若用F装置收集CO2,并测量CO2气体的体积,其中在水面上放一层植物油目的是防止二氧化碳气体溶于水中.
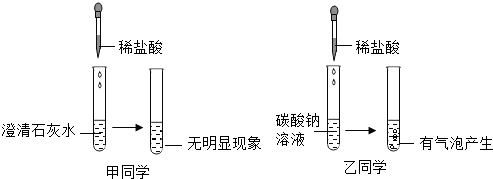
(4)如图2装置(气密性良好),当开启分液漏斗的装置,也滴入盛有固体的试管2中时,观察到不同的现象.
①若试管2中发生了化学反应,观察到试管1中有气泡产生,且其中的石蕊溶液变红,则试管2中的液体可能是稀盐酸.
②若试管2中没有发生化学反应,观察到试管1中导管口冒气泡,且锥形瓶内的澄清石灰水变浑浊,则试管2中的固体可能是氢氧化钠.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.加热氯化铵和氢氧化钙的固体混合物制取,因此需要加热;NH3密度比空气小,极易溶于水,因此氨气只能用向下排空气法收集.若用F装置收集CO2,并测量CO2气体的体积,其中在水面上放一层植物油目的是:防止二氧化碳气体溶于水中;若试管2中发生了化学反应,观察到试管1中有气泡产生,且其中的石蕊溶液变红,则试管2中的液体可能是稀盐酸,若试管2中没有发生化学反应,观察到试管1中导管口冒气泡,且锥形瓶内的澄清石灰水变浑浊,则试管2中的固体可能是氢氧化钠.
解答 解:(1)如果用双氧水和二氧化锰制氧气就不需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;故答案为:O2或H2;
(2)加热氯化铵和氢氧化钙的固体混合物制取,因此需要加热;NH3密度比空气小,极易溶于水,因此氨气只能用向下排空气法收集;故答案为:AD;
(3)若用F装置收集CO2,并测量CO2气体的体积,其中在水面上放一层植物油目的是:防止二氧化碳气体溶于水中;故答案为:防止二氧化碳气体溶于水中;
(4)若试管2中发生了化学反应,观察到试管1中有气泡产生,且其中的石蕊溶液变红,则试管2中的液体可能是稀盐酸,若试管2中没有发生化学反应,观察到试管1中导管口冒气泡,且锥形瓶内的澄清石灰水变浑浊,则试管2中的固体可能是氢氧化钠;故答案为:①稀盐酸;②氢氧化钠;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和气体的性质等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. |  液体滴加 | B. |  液体加热 | C. |  固体粉末取用 | D. |  液体倾倒 |
 牙膏是和牙刷一起用于清洁牙齿,保护口腔卫生,是对人体安全的一种日用必需品.某化学兴趣小组对某种牙膏的成分进行了如下探究:
牙膏是和牙刷一起用于清洁牙齿,保护口腔卫生,是对人体安全的一种日用必需品.某化学兴趣小组对某种牙膏的成分进行了如下探究:探究一:牙膏的酸碱性
实验1:取少量牙膏放入烧杯中,加入足量的水溶解,静置,取上层清液,测定溶液的 pH,pH>7(填”>”或”<”),牙膏呈碱性.
探究二:牙膏摩擦剂的成分
小明同学发现实验1烧杯底部有沉淀,便想探究其成分.
【查阅资料】牙膏成分中的固体原料为磨擦剂,它是擦去牙齿表面牙垢,减轻牙渍的成分.常见的摩擦剂有碳酸钙、二氧化硅(SiO2)等.
【猜想与假设】该牙膏摩擦剂成分可能是:①为碳酸钙;②二氧化硅;③你的猜想是碳酸钙和二氧化硅混合物.
实验2:【设计方案和实验】
| 步骤 | 现象 | 结论 |
| ①取少量沉淀,加入适量稀盐酸 | 沉淀完全溶解,有气泡产生 | 假设①正确(填序号) |
| ②将产生的气体通入澄清的石灰水 | 澄清石灰水变浑浊 |
 兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:【提出问题】氢氧化钠溶液与稀盐酸混合是否发生了化学反应?
【猜想与假设】
a.二者混合发生了化学反应
b.二者混合没有发生化学反应
【设计并实验】
| 实验操作 | 实验现象 | |
| 甲同学 | 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
| 乙同学 | 在盛有10 mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞溶液,然后再加入稀硫酸 | 溶液由红色变为无色 |
(1)乙同学认为甲的设计不合理,原因是滴加水也会使溶液pH减小,改进的方法是滴加足量硫酸一直到溶液pH等于7或小于7,根据改进的实验现象说明二者混合后发生了化学变化,写出氢氧化钠与稀硫酸反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究稀硫酸与氢氧化钠溶液是否恰好完全反应.
乙同学在做完稀硫酸与氢氧化钠溶液反应得到实验后,为探究稀硫酸与氢氧化钠是否恰好完全反应,设计了实验方案二
【思考与交流】
| 实验步骤 | 实验现象 | 结论 |
| 取少量碳酸钠固体于试管中滴加乙同学上述反应后的溶液于试管中 | 若有气泡生成 | 稀硫酸过量(“过量”或“不过量” |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
(3)根据图示分析,稀硫酸和氢氧化钠的反应是放热(填“吸热”或“放热”)反应,加入稀硫酸10mL时,二者恰好完全反应.
| A. | Cu→CuSO4 | B. | H2SO4→HCl | C. | KNO3→KCl | D. | Fe→Fe2(SO4)3 |
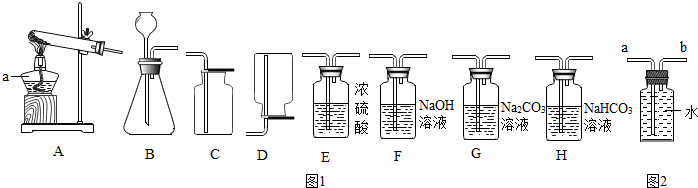
(1)仪器a的名称是酒精灯,a应在固定试管之前(选填“前”或“后”)放置.
(2)实验室制取氧气时,常用A装置制取并在试管口塞一团棉花,其化学反应方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;若选用B装置制取,其化学反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.选用的收集装置是C(填字母序号)若改用如图2装置收集气体,则气体应从b进(填“a”或“b”)
(3)甲同学在实验室制取二氧化碳的研究中,进行了如下实验:
| 药品实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号).
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积);.
Ⅳ.研究发现酸的浓度越大,产生的气体的速度越快,与甲比较,对丁分析正确的是AB
A.反应更为剧烈 B.最终剩余溶液的质量更小
C.产生的二氧化碳的质量更大 D.粉末状大理石利用率更高
(4)乙同学也取了一定浓度的盐酸与石灰石反应制取气体,并将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】
A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②乙同学想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3溶液中 | 产生白色沉淀 | 气体中有HCl |
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).
| A. | 冰块 | B. | 蔗糖 | C. | 面粉 | D. | 奶油 |