题目内容
10.实验室常用图1装置制取气体,请你根据所学知识回答下列问题.(1)仪器a的名称是酒精灯,a应在固定试管之前(选填“前”或“后”)放置.
(2)实验室制取氧气时,常用A装置制取并在试管口塞一团棉花,其化学反应方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;若选用B装置制取,其化学反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.选用的收集装置是C(填字母序号)若改用如图2装置收集气体,则气体应从b进(填“a”或“b”)
(3)甲同学在实验室制取二氧化碳的研究中,进行了如下实验:
| 药品实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
Ⅱ.若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙对照(选填实验编号).
Ⅲ.除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积);.
Ⅳ.研究发现酸的浓度越大,产生的气体的速度越快,与甲比较,对丁分析正确的是AB
A.反应更为剧烈 B.最终剩余溶液的质量更小
C.产生的二氧化碳的质量更大 D.粉末状大理石利用率更高
(4)乙同学也取了一定浓度的盐酸与石灰石反应制取气体,并将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】
A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2.
②乙同学想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3溶液中 | 产生白色沉淀 | 气体中有HCl |
碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O=2NaHCO3
【拓展延伸】
如果用上述原料制得纯净的二氧化碳气体,所选仪器的连接顺序为BHEC(填字母).
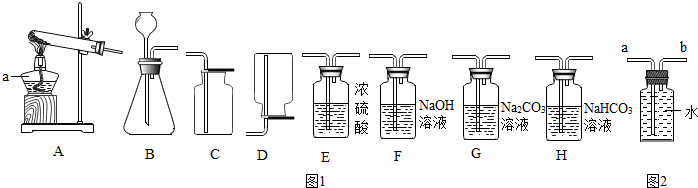
分析 (1)根据实验室常用仪器的名称和连接仪器 的顺序进行分析;
(2)A装置制取并在试管口塞一团棉花,说明是用加热高锰酸钾的方法制取氧气,据反应原理书写方程式,B装置属于固液常温型,用过氧化氢制取氧气可用此发生装置,据反应原理书写方程式;并根据氧气的密度比空气大,不易溶于水,氧气密度比水小进行分析;
(3)大理石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳;根据实验数据分析比较解答;
(4)【实验探究】①根据碱能使酚酞变红色进行分析;
②根据氯离子和银离子会生成氯化银沉淀进行分析;
【拓展延伸】根据实验室制取二氧化碳的反应物是固体和液体,反应条件生成物,生成的二氧化碳中含有氯化氢气体、水蒸气,需要先用碳酸氢钠溶液将氯化氢除去,再用浓硫酸干燥,然后用向上排空气法收集二氧化碳进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,a是酒精灯,连接仪器时应该按照从下到上的顺序,所以酒精灯应在固定试管之前放置;
(2)A装置制取并在试管口塞一团棉花,说明是用加热高锰酸钾的方法制取氧气,反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,B装置属于固液常温型,用过氧化氢制取氧气可用此发生装置,反应的化学方程式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;氧气的密度比空气大,不易溶于水,所以收集氧气可以用排水法和向上排空气法进行收集,选用的收集装置是C,氧气密度比水小,所以改用图2装置收集氧气,则气体应从b进入;
(3)Ⅰ、碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
Ⅱ、对比实验数据可见,甲和乙均为mg块状大理石,wg盐酸,但是盐酸的浓度不同;
Ⅲ、甲和丙对比,乙和丁对比可知,实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积);故填:
Ⅳ、甲和丁对比可知,丁中反应之间的接触面积大,盐酸浓度大,所以反应的速率更快;
丁为浓盐酸,具有挥发性,所以溶液的质量更小;
因为并不知道大理石与盐酸是否完全反应还是哪一种物质有剩余,故无法判断产生二氧化碳的质量粉末状大理石利用率.
故填:ab;
(4)【实验探究】①碱能使酚酞变红色,所以排除猜想A的理由是:酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2;
②氯离子和银离子会生成氯化银沉淀,氯化氢溶于水形成盐酸,所以
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3 溶液中 | 产生白色沉淀 | 气体中有HCl |
故答案为:(1)酒精灯;前;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;C,b;
(3)Ⅰ、CaCO3+2HCl=CaCl2+CO2↑+H2O;
Ⅱ、乙;
Ⅲ、固体反应物的颗粒大小(或反应物的接触面积);
Ⅳ、AB;
(4)【实验探究】①酚酞试液变红,说明溶液中存在碱性物质Ca(OH)2;
②
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3 溶液中 | 产生白色沉淀 | 气体中有HCl |
点评 本题主要考查常见气体的发生装置与收集装置的探究,对影响实验速率的因素的探究、化学方程式的书写以及仪器的组装,对气体的检验等知识,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择,是一道不错的综合题.


| 实验方案 反应现象 | 方案一(A图) (1)产生大量白烟 | 方案一(B图) 产生大量的气泡 | 方案一(C图) (2)铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色 |
| 反应前的总质量 | m1 | W1 | n1 |
| 反应后的总质量 实验结论分析 | m2 (3)A同学实验:白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡.结论:质量不守恒.你认为该结论是否正确不正确 | w2 (4)w1>w2 | n2 n1=n2 |
(6)写出方案三(C)中化学方程式Fe+CuSO4=FeSO4+Cu;
(7)A同学实验结论是天平不平衡(游码在零处)的原因可能是①③(选择序号).
①没有塞好塞子,有白烟冒出;②物体和密码放反了;③白磷刚引燃,立即将锥形瓶放到天平上称量,致使气球膨胀产生空气浮力.
| A. | KNO3 | B. | Ca3(PO4)2 | C. | NH4Cl | D. | K2CO3 |
| A. | 生铁和钢的性能不同--含碳量不同 | |
| B. | CO和C02的化学性质不同--分子构成不同 | |
| C. | 钠原子和钠离子化学性质不同--质子数不同 | |
| D. | 金刚石和石墨的物理性质不同--原子排列方式不同 |
 铟具有光渗透性和强导电性,广泛用于生产液晶显示器.元素周期表中“铟”的信息如图所示.下列关于铟元素说法,错误的是( )
铟具有光渗透性和强导电性,广泛用于生产液晶显示器.元素周期表中“铟”的信息如图所示.下列关于铟元素说法,错误的是( )| A. | 是非金属元素 | B. | 元素符号为Ir | ||
| C. | 相对原子质量为114.82 | D. | 原子序数为49 |
 ”表示碳原子、“
”表示碳原子、“ ”表示氮原子、“
”表示氮原子、“ ”表示氧原子).下列说法错误的是( )
”表示氧原子).下列说法错误的是( )
| A. | 反应前后碳元素的化合价发生了变化 | |
| B. | 反应后有三种物质生成 | |
| C. | 参加反应的两种分子的个数比为1:1 | |
| D. | 反应中有单质生成 |

