题目内容
13.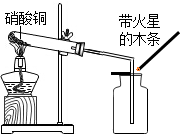 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.【提出问题】硝酸铜在加热条件下到底发生了怎样的反应
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验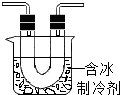 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
分析 【猜想假设】根据质量守恒定律和资料推测Cu(NO3)2受热分解除了生成NO2;
【进行实验】因为氧化铜难溶于水,可以通过溶解,过滤,洗涤的方式与可溶性物质进行分离.而后加热稀硫酸,稀硫酸与氧化铜反应生成硫酸铜,得到蓝色溶液;NO2气体易液化,通过含冰制冷剂能将其液化;从而与其他气体分离,剩余的气体仍可以使带火星木条复燃,说明Cu(NO3)2受热分解还生成了氧气;
【获得结论】根据实验结果,Cu(NO3)2受热分解生成CuO、NO2、O2,故可书写化学方程式;
【反思与评价】通过化学反应,硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
解答 解:
【猜想假设】根据“加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃”、“②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.③NO2有助燃性,能使带火星的木条复燃”和质量守恒定律,推测Cu(NO3)2受热分解除了生成NO2;
【进行实验】因为氧化铜难溶于水,可以通过溶解,过滤,洗涤的方式与可溶性物质进行分离.而后加热稀硫酸,稀硫酸与氧化铜反应生成硫酸铜,得到蓝色溶液,其化学方程式为CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O;NO2气体易液化,通过含冰制冷剂能将其液化;从而与其他气体分离,剩余的气体仍可以使带火星木条复燃,说明Cu(NO3)2受热分解还生成了氧气;
【获得结论】根据实验结果,Cu(NO3)2受热分解生成CuO、NO2、O2,故可书写化学方程式2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
【反思与评价】通过化学反应,硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性;
故答案为:
【猜想假设】NO2;
【进行实验】①过滤,洗涤,向滤渣中加入足量稀硫酸;
②NO2的沸点(或低温下NO2能否反应生成液态或固态物质);
【获得结论】2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
【分析及反思】硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
点评 本题考查了化学方程式的书写,又考查了同学们实验方案的设计,难度较大,注意根据实验目的设计实验方案.

| A. | P2O5---五氧化二磷 | B. | O2---2个氧原子 | ||
| C. | Ca2+---钙离子 | D. | 2H2O---2个水分子 |
| 题号 | 化学方程式 | 评价 | 反应类型 |
| (1) | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | ①B | ②b |
| (2) | 2H2O$\frac{\underline{\;电解\;}}{\;}$H2+O2↑ | ③C | ④a |
反应类型序号:a分解反应 b化合反应.
| ①将等体积的两种无色液体分别加入A、B两个试管中. ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象.  | A试管中无明显现象 B试管中有气泡产生 | A试管中的无色液体是:水(H2O); B试管中的无色液体是:双氧水(H2O2) |
(2)如何验证B试管中产生的气体,请试着完成下表:
| 猜想 | 验证方法及操作 | 实验现象 | 结论 |
| A. | CaO | B. | Al2O3 | C. | SiO2 | D. | Fe3O4 |




