题目内容
8.端午节,小明利用家中的一些物品和材料做一组以鸡蛋为主题的小实验和小游戏:
(1)巧竖鸡蛋:用玻璃棒蘸稀盐酸,涂在蛋壳大头的顶端部分,再重复涂几次,过一会儿用水冲洗,发现蛋壳被涂盐酸的地方变软了,可将鸡蛋竖立于桌面;用同样方法处理另一枚鸡蛋,并竖立于第一枚鸡蛋之上(如图甲).写出稀盐酸使蛋壳变软时发生反应的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)烹制美味小菜--“番茄炒蛋”,如图乙.将一个洗净的番茄从中央剖开,会看到番茄中有许多种子,这是因为番茄花的子房中含有多个胚珠;“番茄炒蛋”中的蛋白质进入人体后,首先在胃中被初步消化,然后在小肠内被彻底消化成氨基酸.
(3)小明用锅子煮了两鸡蛋,如图丙所示.在煮鸡蛋过程中,锅中水吸收的热量大于两鸡蛋吸收的热量,这是因为水的质量和比热容都比鸡蛋的大;拿出两个熟鸡蛋做“撞蛋”游戏,如图丁所示,两鸡蛋相撞,一蛋破碎,另一蛋未破,小明认为这是因为一只蛋受到较大的作用力,所以破碎了.请你判断小明的观点是否正确,并分析一蛋破碎、一蛋未破的原因:不正确,在相撞的时候二者受的力是相同的,只是破的鸡蛋受的压强超过了它能承受的能力,而未破的鸡蛋承受的压强未超过它承受的能力.
分析 根据盐酸与碳酸钙的反应解答,根据植物的生长以及食物的消化解答,根据物理力的知识解答.
解答 解:(1)蛋壳的主要成分是碳酸钙,能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)种子的数目决定于子房中胚珠的数目,将一个洗净的番茄从中央剖开,会看到番茄中有许多种子,这是因为番茄花的子房中含有多个胚珠;蛋白质进入人体后,首先在胃中被初步消化,然后在小肠内被彻底消化成氨基酸,故填:子房中含有多个胚珠,氨基酸;
(3)在煮鸡蛋过程中,水的质量和比热容都大于鸡蛋,故锅中水吸收的热量大于两鸡蛋吸收的热量;小明的观点不正确,因为在相撞的时候二者受的力是相同的,只是破的鸡蛋受的压强超过了它能承受的能力,而未破的鸡蛋承受的压强未超过它承受的能力,故填:水的质量和比热容都比鸡蛋的大;不正确,在相撞的时候二者受的力是相同的,只是破的鸡蛋受的压强超过了它能承受的能力,而未破的鸡蛋承受的压强未超过它承受的能力.
点评 本题综合考查了物质的性质、植物的生长和食物的吸收以及力的知识,完成此题,需要综合掌握理化生的知识.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
18.下列实验操作不正确的是( )
| A. |  倾倒液体 | B. |  检验气密性 | C. |  点燃酒精灯 | D. |  稀释浓硫酸 |
19.填表:
| 化学符号 | O2 | 2He | $\stackrel{+2}{Ca}$ | ||
| 表示意义 | 钠元素 | 硝酸根 |
3.甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )


| A. | 甲实验试管口向下倾斜可防止反应生成的水倒流 | |
| B. | 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 | |
| C. | 甲、乙两实验中,都应先使试管、玻璃管均匀受热,再通入气体,以防止发生爆炸 | |
| D. | 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 |
13.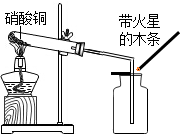 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
步骤II是同学们查阅了新的资料后设计完成的.该资料是关于NO2的沸点(或低温下NO2能否反应生成液态或固态物质)方面的性质信息.
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.【提出问题】硝酸铜在加热条件下到底发生了怎样的反应
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验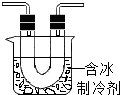 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
20.下列物质的用途中,利用其化学性质的是( )
①氦气用于冲灌空气球;②氧气用于电焊;③干冰用于制冷;④用自来水制造蒸馏水.
①氦气用于冲灌空气球;②氧气用于电焊;③干冰用于制冷;④用自来水制造蒸馏水.
| A. | ①、②、③ | B. | ② | C. | ①、④ | D. | ①、④、⑤ |
17. 根据表格回答:部分酸、碱和盐在水中的溶解性(20℃)
根据表格回答:部分酸、碱和盐在水中的溶解性(20℃)
(1)从表中找出一种微溶性盐CaSO4(填化学式).
(2)NaNO3、CuCl2两种溶液不能发生复分解反应(选填“能”或“不能”).
(3)现有一包固体粉末,可能是CaCO3、Na2CO3、CuSO4、NaCl中的一种或几种,为确定其组成,取适量试样进行下列实验.请根据实验现象判断:
①取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有CaCO3、CuSO4.
②取上述溶液适量,滴加盐酸溶液后产生气泡.则此固体粉末中一定有Na2CO3.
(4)现有盐酸和CaCl2的混合溶液,向其中逐渐加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X是D.(选填字母编号)
A.水 B.稀盐酸 C.氯化铵溶液 D.纯碱溶液.
 根据表格回答:部分酸、碱和盐在水中的溶解性(20℃)
根据表格回答:部分酸、碱和盐在水中的溶解性(20℃)| 阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | 不 |
(2)NaNO3、CuCl2两种溶液不能发生复分解反应(选填“能”或“不能”).
(3)现有一包固体粉末,可能是CaCO3、Na2CO3、CuSO4、NaCl中的一种或几种,为确定其组成,取适量试样进行下列实验.请根据实验现象判断:
①取试样溶于水,得到无色澄清溶液,则此固体粉末中一定没有CaCO3、CuSO4.
②取上述溶液适量,滴加盐酸溶液后产生气泡.则此固体粉末中一定有Na2CO3.
(4)现有盐酸和CaCl2的混合溶液,向其中逐渐加入过量的某物质X,溶液的pH随滴入X的量的变化关系如图所示,则X是D.(选填字母编号)
A.水 B.稀盐酸 C.氯化铵溶液 D.纯碱溶液.