题目内容
18.列式并计算.(1)Ca(OH)2 相对分子质量.
(2)P2O5中各元素的质量比.
(3)NH4NO3中氮元素的质量分数.
分析 (1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;
(3)据硝酸铵的化学式和元素的质量分数公式进行计算即可.
解答 解:(1)Ca(OH)2的相对分子质量为40+(16+1)×2=74.故答案为:74;
(2)由化学式为P2O5,则磷与氧元素的质量比为(31×2):(16×5)=31:40,故填:P:O=31:40;
(3)根据硝酸铵的化学式可知,氮元素的质量分数为:$\frac{14×2}{14+4+14+16×3}$×100%=35%.故填:35%.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
8. 某化学小组的同学在学习《奇妙的二氧化碳》时,设计了如图所示的实验:
某化学小组的同学在学习《奇妙的二氧化碳》时,设计了如图所示的实验:
问题讨论:
(1)步骤①中现象产生的原因是二氧化碳溶于水并且与水反应使瓶内气压变小,此实验说明,在密闭的体系内,气压变小的原因是气体减少.
(2)步骤②中的操作是将注射器3中的澄清石灰水推入三颈烧瓶中,发生反应的文字表达式为二氧化碳+氢氧化钙$\stackrel{.}{→}$碳酸钙+水.
(3)③中产生的另一现象为“且气泡冒出”,发生反应的化学符号CaCO3+2HCl═CaCl2++CO2↑+H2O.
 某化学小组的同学在学习《奇妙的二氧化碳》时,设计了如图所示的实验:
某化学小组的同学在学习《奇妙的二氧化碳》时,设计了如图所示的实验:| 实验步骤及操作 | 实验现象 |
| ①将注射器1中的水推入充有CO2的三颈烧瓶中,振荡 | 气球略微鼓起 |
| ②将注射器3中的澄清石灰水推入三颈烧瓶中 | 澄清石灰水变浑浊 |
| ③将注射器2中的溶液推入三颈烧瓶中 | 溶液变澄清且气泡冒出,气球变瘪 |
(1)步骤①中现象产生的原因是二氧化碳溶于水并且与水反应使瓶内气压变小,此实验说明,在密闭的体系内,气压变小的原因是气体减少.
(2)步骤②中的操作是将注射器3中的澄清石灰水推入三颈烧瓶中,发生反应的文字表达式为二氧化碳+氢氧化钙$\stackrel{.}{→}$碳酸钙+水.
(3)③中产生的另一现象为“且气泡冒出”,发生反应的化学符号CaCO3+2HCl═CaCl2++CO2↑+H2O.
6.小红学习了元素周期表的相关知识后,对教材中“元素周期表也可以竖着(按族)读,每一竖列中元素的化学性质都很相似”这个说法产生了兴趣,她和同学们进行如下探究:
【提出问题】查阅元素周期表后发现钙元素和镁元素同在一个竖列里,她已经知道氢氧化钙溶液能使酚酞试液变红,她通过实验来探究不溶性的氢氧化镁是否也能使酚酞试液变红:将适量氢氧化镁分别加入到盛有冷水和热水的烧杯中,搅拌并分别向两烧杯中滴加酚酞试液,发现盛冷水的烧杯中酚酞试液没有变红,盛热水的烧杯中酚酞试液变红,但放置后红色又消失了.盛热水的烧杯中酚酞试液变红、放置后红色又消失的原因是什么?
【作出猜想】甲同学认为可能是放入热水中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色了.小红则认为可能是在热水中氢氧化镁的溶解度大,溶液中OH-离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH-离子变少,酚酞试液又变无色.
【讨论交流】(1)小红认为甲同学的猜想不正确,请你阐述固体氢氧化镁不能使酚酞试液变色的原因:固体氢氧化镁中没有自由移动的OH-离子,不能使酚酞试液变红;乙同学认为上述酚酞试液变红、放置后红色又消失的现象还可能是由其他因素引起的.
【实验验证】(2)①乙同学设计了下列实验,请写出他的设计目的:
②小红设计了下列对比实验方案证明自己的猜想,请将其方案补充完整:
【提出问题】查阅元素周期表后发现钙元素和镁元素同在一个竖列里,她已经知道氢氧化钙溶液能使酚酞试液变红,她通过实验来探究不溶性的氢氧化镁是否也能使酚酞试液变红:将适量氢氧化镁分别加入到盛有冷水和热水的烧杯中,搅拌并分别向两烧杯中滴加酚酞试液,发现盛冷水的烧杯中酚酞试液没有变红,盛热水的烧杯中酚酞试液变红,但放置后红色又消失了.盛热水的烧杯中酚酞试液变红、放置后红色又消失的原因是什么?
【作出猜想】甲同学认为可能是放入热水中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色了.小红则认为可能是在热水中氢氧化镁的溶解度大,溶液中OH-离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中OH-离子变少,酚酞试液又变无色.
【讨论交流】(1)小红认为甲同学的猜想不正确,请你阐述固体氢氧化镁不能使酚酞试液变色的原因:固体氢氧化镁中没有自由移动的OH-离子,不能使酚酞试液变红;乙同学认为上述酚酞试液变红、放置后红色又消失的现象还可能是由其他因素引起的.
【实验验证】(2)①乙同学设计了下列实验,请写出他的设计目的:
| 实验步骤 | 设计目的 |
| 将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油 | 证明隔绝空气证明红色消失与氧气和二氧化碳无关. |
| 实验方法及可能观察到的现象 | 结论 | |
| 取A、B两支试管,都加入等质量的Mg(OH)2和等质量的热水,振荡,各滴入数滴无色酚酞. | 对A试管的操作及可观察到的现象温度保持不变;红色没褪去; | 红色消失与氢氧化镁的溶解度随温度降低而减小有关 |
| 对B试管的操作及可观察到的现象自然冷却;红色褪去. | ||
13.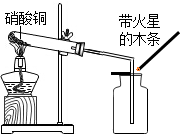 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
步骤II是同学们查阅了新的资料后设计完成的.该资料是关于NO2的沸点(或低温下NO2能否反应生成液态或固态物质)方面的性质信息.
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用如图装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.【提出问题】硝酸铜在加热条件下到底发生了怎样的反应
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成NO2,还可能生成了CuO和O2.
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤I:将反应后试管中的固体加水充分溶解,过滤,洗涤,向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤II:在如图的试管和集气瓶之间连上如图所示的装置,重新进行加热硝酸铜的实验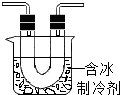 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】
根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
7. 若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)
若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)
 若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)
若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)| A. | 65n/73≤m 或56n/73≤m | B. | 65n/73≤m 或56n/73≤m | ||
| C. | 65n/73≤m 或56n/73≥m | D. | 65n/73≥m 或56n/73≥m |
11.有关分子、原子的说法不正确的是( )
| A. | 氮分子是保持氮气化学性质的最小粒子 | |
| B. | 化学变化中分子可分、而原子不可分 | |
| C. | 分子能构成物质,而原子不能 | |
| D. | 原子是化学变化中的最小粒子 |
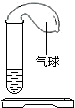 如图所示,开始在气球中装有某种固体,在试管中装有某种液体,实验之前,气球是瘪的.实验时,把气球中的固体倒入试管中,发现气球慢慢变大.请你预测该固体和液体药品.(提示:可以填物质的化学式,也可以填物质的名称)
如图所示,开始在气球中装有某种固体,在试管中装有某种液体,实验之前,气球是瘪的.实验时,把气球中的固体倒入试管中,发现气球慢慢变大.请你预测该固体和液体药品.(提示:可以填物质的化学式,也可以填物质的名称)