题目内容
20.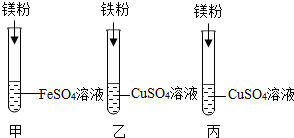 某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:(1)试管乙中反应的化学方程式为Fe+CuSO4═FeSO4+Cu.
(2)同学们经讨论后认为该方案可以优化,丙试管的实验是多余的.
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液,并对不溶物的成分进行如下探究:
【提出问题】烧杯中不溶物的成分是什么?
【实验探究】向过滤得到的不溶物中加稀硫酸
①若无气泡产生,则不溶物的成分是铜;
②若有气泡产生,则不溶物中一定含有铜、铁,可能含有镁.
分析 (1)试管乙中铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,现象是溶液有蓝色变为浅绿色,生成红色固体;
(2)甲、乙就可以证明三种金属的活动性强弱,故丙是多余的;
(3)①向过滤得到的不溶物中加稀硫酸,无气泡产生,根据金属能否与酸反应解答;
②向过滤得到的不溶物中加稀硫酸,有气泡产生,根据金属能否与酸反应解答.
解答 解:(1)试管乙中铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液;反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
(2)甲、乙就可以证明三种金属的活动性强弱Mg>Fe>Cu,故丙是多余的;
(3)向过滤得到的不溶物中加稀硫酸,①无气泡产生,说明不溶物中没有镁和铁,故不溶物的成分是铜;
②有气泡产生,若镁过量,则铜盐和铁盐均被置换出来,不溶物中含有镁、铁、铜,若镁少量,则不溶物中一定含有铁和铜,因此不溶物中一定含有铁和铜,可能含有镁;
答案:(1)Fe+CuSO4═FeSO4+Cu;
(2)丙;
(3)①铜;②铜、铁;镁.
点评 本题考查了学生的实验设计能力,属于能力提高型习题,且本题具有开放性,学生的思维空间较大.能培养学生创新设计的能力.开放型习题有助于学生对知识的综合应用.

练习册系列答案
相关题目
11. 构建知识网络,理清物质间的相互关系,是科学学习中的一种重要方法.如图中连线两端的物质可以相互反应.下列四组选项中,符合该图要求的是( )
构建知识网络,理清物质间的相互关系,是科学学习中的一种重要方法.如图中连线两端的物质可以相互反应.下列四组选项中,符合该图要求的是( )
 构建知识网络,理清物质间的相互关系,是科学学习中的一种重要方法.如图中连线两端的物质可以相互反应.下列四组选项中,符合该图要求的是( )
构建知识网络,理清物质间的相互关系,是科学学习中的一种重要方法.如图中连线两端的物质可以相互反应.下列四组选项中,符合该图要求的是( )| A. | ①Na2CO3 ②SO3 ③BaCO3 | B. | ①NaHCO3 ②SO2 ③KNO3 | ||
| C. | ①Fe2O3 ②CO2③Ba(NO3)2 | D. | ①CuO ②CO③HCl |
15.下列应用的原理(用化学方程式表示)及基本反应类型均正确的是( )
| A. | 用赤铁矿高炉炼铁 Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 | |
| B. | 硫酸厂污水可用熟石灰中和处理 H2SO4+Ca(OH)2═CaSO4+H2O 复分解反应 | |
| C. | 加热二氧化锰和氯酸钾的混合物制取氧气 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑分解反应 | |
| D. | 用红磷测定空气中氧气含量 4P+5O2$\frac{\underline{\;燃烧\;}}{\;}$2P2O5 氧化反应 |
5.下列物质的用途只能体现物理性质的是( )


| A. | ②④ | B. | ①② | C. | ③④ | D. | ①③ |
12.除去下列物质中的少量杂质,所选用的试剂或操作方法正确的是( )
| 选项 | 物质 | 杂质 | 试剂 | 操作方法 |
| A | KCl | K2CO3 | 足量稀盐酸 | 过滤,蒸发,结晶 |
| B | 稀硫酸 | CuSO4 | 适量Ba(OH)2溶液 | 过滤 |
| C | NaCl溶液 | CaCl2 | 适量的碳酸钠溶液 | 过滤,蒸发,结晶 |
| D | N2 | O2 | 铜网 | 通过灼热的铜网 |
| A. | A | B. | B | C. | C | D. | D |
10.将硫酸氢钠溶液滴入盛有锌粒的试管中,可以观察到锌粒表面有气泡产生,该反应的化学方程式为:Zn+2NaHSO4=ZnSO4+Na2SO4+H2↑,某同学就该实验的现象及反应化学方程式,得出以下结论,其中正确的是( )
| A. | 单质跟化合物反应生成新的单质和新的化合物的反应一定是置换反应 | |
| B. | 上述反应中,金属锌变成锌离子进入溶液,实际上是金属得到了电子 | |
| C. | 硫酸氢钠电离时产生的阳离子含氢离子,故硫酸氢钠溶液呈酸性 | |
| D. | 硫酸氢钠与金属锌反应后的产物是盐和氢气,符合酸的共性,硫酸氢钠属于酸类 |


