题目内容
9.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁元素的质量分数,某科学兴趣小组的同学进行了如下实验,请你参与过程并分析.【资料】草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:H2C2O4•3H2O$→_{△}^{浓H_{2}SO_{4}}$CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是d(填字母编号).

【问题讨论】将(1)中产生的气体通入下图所示装置进行实验:

实验前应先检查装置的气密性.
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是ca(填字母编号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
【数据分析与计算】
(3)称取铁红样品12.0g,用上述装置进行实验,测定铁红中铁元素的质量分数.
实验前后称得E装置增重8.8g,则此铁红中铁的质量分数是73.3%.(精确到0.1%)
【实验评价】反思:
(4)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
分析 草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,因此选用d装置;二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,二氧化碳可以用浓硫酸干燥;如果全部是氧化铁,铁的最少量是12g×70%=8.4g,如果全部是氧化亚铁,铁的最大量是12g×77.8%=9.336g;E装置增重8.8g,那么二氧化碳是8.8g,氧元素的质量=8.8g×$\frac{32}{44}$=6.4g,因为一个一氧化碳分子只能抢氧化铁中一个氧原子变成二氧化碳,因此氧元素的质量一半一半,6.4g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是6.4g÷2=3.2g,则铁红中铁的质量分数=$\frac{12g-3.2g}{12g}$×100%=73.3%;本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小.
解答 解:(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,因此选用d装置,故答案为:d
(2)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥;故答案为:c;a
(3)如果全部是氧化铁,铁的最少量是12g×70%=8.4g,如果全部是氧化亚铁,铁的最大量是12g×77.8%=9.336g;E装置增重8.8g,那么二氧化碳是8.8g,氧元素的质量=8.8g×$\frac{32}{44}$=6.4g,因为一个一氧化碳分子只能抢氧化铁中一个氧原子变成二氧化碳,因此氧元素的质量一半一半,6.4g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是6.4g÷2=3.2g,则铁红中铁的质量分数=$\frac{12g-3.2g}{12g}$×100%=73.3%;故答案为:73.3%
实验反思:本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;
故答案为:(1)d (2)ca (3)73.3% (4)偏小.
点评 本考点属于实验探究题,实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验现象和分析,得到了正确的结论,属于实验过程和结论的探究.同学们要具体分析,综合掌握.本题型主要出现在实验题中.

 名校课堂系列答案
名校课堂系列答案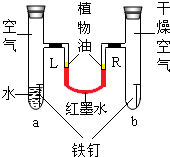 如图是探究铁锈蚀条件的装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察.下列推断错误的是( )
如图是探究铁锈蚀条件的装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察.下列推断错误的是( )| A. | b管中铁钉不容易锈蚀 | |
| B. | 铁锈蚀可能与空气、水有关 | |
| C. | L端与R端液面高度仍然保持一致 | |
| D. | a管中浸没在水中的那部分铁钉不容易锈蚀 |
| A. |  | B. |  | C. |  | D. |  |
| A. |  取用固体药品 | B. |  闻药品味道 | ||
| C. |  用100mL量筒量取8.5mL盐酸 | D. |  滴加液体 |
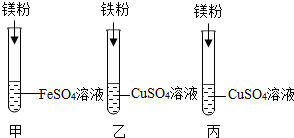 某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
 概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系.请回答:
概念图能清晰地反映概念之间的联系,如图表示溶液中部分概念的相互联系.请回答: