题目内容
15.城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图: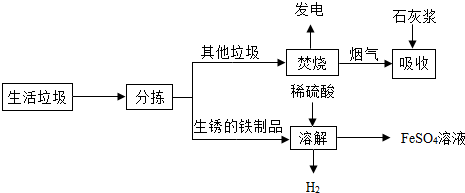
资料1:垃圾焚烧产生烟气中含有SO2、HCl等有害气体.
资料2:+2价的铁元素容易被空气中的氧气氧化.
回答下列问题:
(1)焚烧垃圾发电厂是将垃圾焚烧后获得的热能,最终转化为电能;
(2)在上述流程的“吸收”步骤中,石灰浆的作用是2HCl+Ca(OH)2═CaCl2+2H2O;(用其中任1个反应的化学方程式表示)
(3)在上述流程的“溶解”步骤中,发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有2个反应,其中有单质生成的化学方程式是Fe+H2SO4═FeSO4+H2↑;
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示:(仅在56.7℃或64℃温度下可同时析出两种晶体).
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它二种硫的氧化物,试写出该反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(7)请你就扬州市生活垃圾处理提一条建议生活垃圾分类回收等.
分析 (1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)根据石灰浆是碱性分析;
(3)化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;
(4)根据制取硫酸亚铁晶体的基本操作解答;
(5)根据图表中的信息可以知道当温度大于64℃时产生了FeSO4•4H2O,可以据此解答该题;
(6)根据题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁、二氧化硫和三氧化硫,可以据此写出该反应的化学方程式.
(7)生活垃圾分类回收等.
解答 解:
(1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)石灰浆显碱性,能够吸收酸性气体,所以吸收步骤中,石灰浆的作用是除去烟气中含有的SO2、HCl;反应的化学方程式为:盐酸和氢氧化钙反应生成氯化钙和水,反应的化学方程式为:2HCl+Ca(OH)2═CaCl2+2H2O.:氢氧化钙和二氧化硫反应生成亚硫酸钙和水,反应的化学方程式为:SO2+Ca(OH)2═CaSO3↓+H2O.
(3)溶解步骤中,硫酸与铁反应,生成氢气,所以产生的H2的化学方程式为Fe+H2SO4═FeSO4+H2↑;
(4)操作②的目的是得到硫酸亚铁铵晶体,基本操作步骤:加热浓缩,然后冷却结晶;再过滤;最后洗涤干燥,得到硫酸亚铁晶体,其中氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)根据图表中的信息可以知道当温度大于64℃时产生了FeSO4•4H2O,所以应该将温度控制在64℃以下;
(6)通过题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和三氧化硫,在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等,所以结合元素化合价的变化可以知道,铁元素的化合价由+2变成了+3价,所以反应中有二氧化硫生成,硫元素的化合价由+6降低到+4,所以根据质量守恒定律可以判断在该反应中还生成了三氧化硫,
所以该反应的化学方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(7)请你就成都市生活垃圾处理提一条建议生活垃圾分类回收等.
故答案为:
(1)热;
(2)2HCl+Ca(OH)2═CaCl2+2H2O;
(3)Fe+H2SO4═FeSO4+H2↑;
(4)保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)不超过64℃;
(6)2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
(7)生活垃圾分类回收等.
点评 在解此类题时,应掌握化学方程式的书写、盐的化学性质等知识,并学会分析信息、提取信息,并根据所学知识结合所给信息进行解答.此题涉及的知识点较多,有一定的难度,需要同学们能够掌握全面的知识.

| A. | 安庆石油化工 | B. | 亳州古井酿酒 | C. | 铜陵有色金属 | D. | 六安水力发电 |
| 选项 | 待区分的物质 | 鉴别方法 |
| A | 合成纤维和纯羊毛 | 取样,分别灼烧,并闻气味 |
| B | CaCl2溶液和NaCl溶液 | 取样,分别加入硝酸银溶液,观察是否产生沉淀 |
| C | 稀盐酸和稀硫酸 | 取样,分别AgNO3溶液,观察是否产生沉淀 |
| D | 碳粉和氧化铜 | 取样,分别加入足量稀硫酸,观察是否能溶解 |
| A. | A | B. | B | C. | C | D. | D |
【提出问题】为什么会生成淡黄色固体?
【查阅资料】小光查阅资料,记录了下列几种物质的颜色:
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
【提出猜想】分析资料:小光认为淡黄色固体可能是由镁与空气中的氮气(或N2)反应生成的;
【实验探究】小光设计实验证实了自己的猜想,他的方案可能是将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体.
【实验结论】根据小光的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO、3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
【反思与评价】通过上述实验,你对燃烧的认识燃烧不一定要有氧气参加.
| A. | 自然界的水有部分是纯水 | B. | 净水效果最好的是过滤 | ||
| C. | 硬水过滤后便可以饮用 | D. | 可以用肥皂水来区分硬水和软水 |
甲:氯化钾、二氧化锰
乙:氯酸钾、氯化钾、二氧化锰
丙:氯酸钾、氯化钾
以上猜想中,丙的猜想是错误的,理由一是反应后的物质中没有二氧化锰;理由二是二氧化锰是该反应的催化剂,催化剂在反应前后,质量不变(注:该问可结合实验过程中的真实现象回答).
甲乙同学,为了验证自己的猜想,分别做了如下实验:
甲同学的实验报告如下:
| 实验方法 | 现象 | 结论 |
| 取样,溶于水后过滤 | 得到无色溶液和黑色固体 | 是氯化钾和二氧化锰 |
假如乙同学的猜想正确,请你帮助他完成下列实验报告:
| 实验方法 | 现象 | 结论和反应的符号表达式 |
| 猜想正确 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
| A. | 维生素 | B. | 蛋白质 | C. | 糖类 | D. | 油脂 |
