题目内容
20.小光同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.【提出问题】为什么会生成淡黄色固体?
【查阅资料】小光查阅资料,记录了下列几种物质的颜色:
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
【提出猜想】分析资料:小光认为淡黄色固体可能是由镁与空气中的氮气(或N2)反应生成的;
【实验探究】小光设计实验证实了自己的猜想,他的方案可能是将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体.
【实验结论】根据小光的实验结果,写出镁条在空气中燃烧时发生的两个反应的化学方程2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO、3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
【反思与评价】通过上述实验,你对燃烧的认识燃烧不一定要有氧气参加.
分析 [查阅资料]根据质量守恒定律确定产物中一定不存在氯化镁;
[提出猜想]根据空气的成分和固体的颜色判断淡黄色固体的来源;
[实验探究]根据在纯氧气中燃烧镁条只生成白色固体,在纯氮气中燃烧镁条只生成淡黄色色固体,可采取在纯纯氮气中燃烧镁条,观察现象的方法;
[实验结论]根据反应的反应物、生成物和反应条件书写方程式;
[反思与评价]根据镁可以在氮气中燃烧这一特殊性质分析回答.
解答 解:[查阅资料]根据质量守恒定律,化学反应前后元素的种类不变,由于空气中无氯元素,所以燃烧产物中一定不存在氯化镁;
[提出猜想]空气中含有氮气,在空气中点燃镁条时,生成的白色固体物质中夹杂着少量的淡黄色固体,而氮化镁为淡黄色,所以淡黄色的固体可能是镁与空气中的氮气反应生成的.
[实验探究]由于在纯氧气中燃烧镁条只生成白色固体氧化镁,在纯氮气中燃烧镁条只生成淡黄色色固体氮化镁,可用在纯氮气中燃烧镁条,观察现象的方法.
[实验结论]镁和氧气在点燃的条件下燃烧生成氧化镁,化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;镁和氮气在点燃的条件下反应生成氮化镁,化学方程式:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
[反思与评价]一般情况下,氧气有助燃性,可以支持燃烧,而该题中显示镁在氮气中也可以燃烧,所以启示为:物质不一定只在氧气中才能燃烧或氮气通常不支持燃烧,但有时也能支持某些物质的燃烧.
故答案为:[查阅资料]空气的成分中不含氯元素;
[提出猜想]氮气(或N2);
[实验探究]将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体;
[实验结论]2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
[反思与评价]燃烧不一定要有氧气参加.
点评 正确理解质量守恒定律的内容,了解燃烧的定义及定义的拓展意义是解决问题的关键,书写化学方程式一定要确定反应物和生成物的化学式,不要忘记配平和条件.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 同一物质:火碱,纯碱,苛性钠 | B. | 复合肥料:氯化铵、磷矿粉、硝酸钾 | ||
| C. | 化石燃料:煤、石油、天然气 | D. | 混合物:氢气、石灰石、空气 |
| A. |  连接仪器 | B. |  检查气密性 | C. |  取用石灰石 | D. |  稀释浓硫酸 |
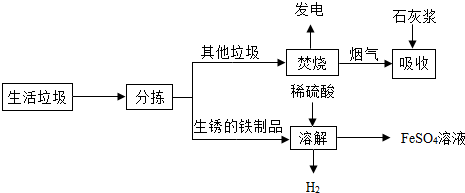
资料1:垃圾焚烧产生烟气中含有SO2、HCl等有害气体.
资料2:+2价的铁元素容易被空气中的氧气氧化.
回答下列问题:
(1)焚烧垃圾发电厂是将垃圾焚烧后获得的热能,最终转化为电能;
(2)在上述流程的“吸收”步骤中,石灰浆的作用是2HCl+Ca(OH)2═CaCl2+2H2O;(用其中任1个反应的化学方程式表示)
(3)在上述流程的“溶解”步骤中,发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有2个反应,其中有单质生成的化学方程式是Fe+H2SO4═FeSO4+H2↑;
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示:(仅在56.7℃或64℃温度下可同时析出两种晶体).
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它二种硫的氧化物,试写出该反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(7)请你就扬州市生活垃圾处理提一条建议生活垃圾分类回收等.
| A. |  | B. |  | C. |  | D. |  |
| A. | 酒精挥发 | B. | 植物发生光合作用 | ||
| C. | 自行车出现生锈 | D. | 蜡烛燃烧 |
| A. | 铁锅 | B. | 瓷碗 | C. | 塑料盆 | D. | 玻璃杯 |

 A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去).
A、B、C、D均含有同一种元素,它们的转化关系如图(部分物质和反应条件已略去).