题目内容
3.液化石油气是生活常用的燃料,右图是液化石油气罐和燃气灶具示意图.(1)图中所标物件中含有的金属单质是Cu(或Fe)(用化学式表示),含有的合金是钢.

(2)液化石油气的主要成分是丁烷(C4H10),请写出丁烷完全燃烧的化学方程式:2C4H10+13O2$\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O,若把燃烧液化石油气的燃气灶改成燃烧天然气(CH4),此时需要减小(填“增大”或“减小”)灶具的进风口.
(3)液化石油气发生泄漏容易引发安全事故,请你写出一种防止发生安全事故的措施保持通风.
分析 (1)根据钢瓶、铜圈中含有金属单质铁、铜;钢属于铁合金解答;
(2)根据已有的知识进行分析,丁烷和甲烷在氧气中燃烧都生成二氧化碳和水,根据甲烷和丁烷燃烧的化学方程式确定空气管口的调动,据此解答;
(3)根据液化石油气密度大于空气的密度,可以在厨房安装液化石油气泄漏报警器,保持通风等解答.
解答 解:
(1)钢瓶、铜圈中含有金属单质铁、铜,铁、铜的化学式分别是Fe、Cu,钢属于铁合金;
(2)丁烷燃烧生成二氧化碳和水,该反应的化学方程式为:2C4H10+13O2 $\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O;甲烷燃烧生成二氧化碳和水,该反应的化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,根据反应的化学方程式可以看出,通入相同体积的甲烷和丁烷,假如都是2体积,则丁烷需要13体积的氧气,而甲烷需要4体积的氧气,故需要将空气进口调小,故填:2C4H10+13O2 $\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O;减小.
(3)液化石油气密度大于空气的密度,房间的下部浓度更大,可以在厨房安装液化石油气泄漏报警器,保持通风等.
答案:
(1)Cu(或Fe),钢.
(2)2C4H10+13O2$\frac{\underline{\;点燃\;}}{\;}$8CO2+10H2O,减小.
(3)保持通风.
点评 本题考查了化学与能源的知识,解答此题的关键是正确书写反应的化学方程式,并且能够进行正确的计算.化学来源于生产、生活,也服务于生产、生活,因此要学好化学知识,为生产、生活服务.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
13.用盐酸和酚酞混合液浸过的滤纸,若在滤纸上分别滴入下列溶液,滤纸上不会出现红色的是( )
| A. | 氯化钠溶液 | B. | 稀硫酸 | C. | 石灰水 | D. | 氢氧化钠 |
14.中考前小明的午餐食谱是:主食--面包;配菜和副食--炸鸡腿、米饭、牛排、牛奶.则该午餐食谱缺乏的营养素是( )
| A. | 维生素 | B. | 脂肪 | C. | 蛋白质 | D. | 糖类 |
8.某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是( )
| A. |  连接仪器 | B. |  检查气密性 | C. |  取用石灰石 | D. |  稀释浓硫酸 |
15.城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图: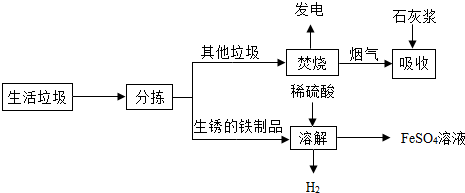
资料1:垃圾焚烧产生烟气中含有SO2、HCl等有害气体.
资料2:+2价的铁元素容易被空气中的氧气氧化.
回答下列问题:
(1)焚烧垃圾发电厂是将垃圾焚烧后获得的热能,最终转化为电能;
(2)在上述流程的“吸收”步骤中,石灰浆的作用是2HCl+Ca(OH)2═CaCl2+2H2O;(用其中任1个反应的化学方程式表示)
(3)在上述流程的“溶解”步骤中,发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有2个反应,其中有单质生成的化学方程式是Fe+H2SO4═FeSO4+H2↑;
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示:(仅在56.7℃或64℃温度下可同时析出两种晶体).
若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为不超过64℃;
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它二种硫的氧化物,试写出该反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(7)请你就扬州市生活垃圾处理提一条建议生活垃圾分类回收等.

资料1:垃圾焚烧产生烟气中含有SO2、HCl等有害气体.
资料2:+2价的铁元素容易被空气中的氧气氧化.
回答下列问题:
(1)焚烧垃圾发电厂是将垃圾焚烧后获得的热能,最终转化为电能;
(2)在上述流程的“吸收”步骤中,石灰浆的作用是2HCl+Ca(OH)2═CaCl2+2H2O;(用其中任1个反应的化学方程式表示)
(3)在上述流程的“溶解”步骤中,发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有2个反应,其中有单质生成的化学方程式是Fe+H2SO4═FeSO4+H2↑;
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示:(仅在56.7℃或64℃温度下可同时析出两种晶体).
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它二种硫的氧化物,试写出该反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(7)请你就扬州市生活垃圾处理提一条建议生活垃圾分类回收等.
12.下列哪种粒子所属元素,与其他三种不属于同一周期的是( )
| A. |  | B. |  | C. |  | D. |  |
13.下列设计方案探究目的不能实现的是( )


| A. | 甲可探究可燃物的燃烧是否需要与氧气接触 | |
| B. | 甲可探究可燃物的燃烧是否需要达到一定的温度 | |
| C. | 乙中①③对比可探究铁的锈蚀条件与氧气是否有关 | |
| D. | 乙中①②③对比可探究铁的锈蚀条件与氧气和水是否有关 |
