题目内容
5.某100g稀盐酸恰好与6.5g锌完全反应,试计算:(1)该反应产生氢气的质量为多少g?
(2)求充分反应后,所得溶液的溶质的质量分数.
分析 据锌的质量结合方程式计算生成氢气的质量,生成的氯化锌的质量,反应后溶液的质量=反应前各组份的质量之和-气体的质量,并据溶质的质量分数计算即可.
解答 解:(1)设生成氢气的质量为x,生成氯化锌的质量为y
Zn+2HCl═ZnCl2+H2↑
65 136 2
6.5g y x
$\frac{65g}{6.5g}=\frac{136}{y}=\frac{2}{x}$
x=0.2g
y=13.6g
(2)反应后所得氯化锌溶液的溶质质量分数=$\frac{13.6g}{100g+6.5g-0.2g}$×100%=12.8%
答:(1)生成氢气的质量为0.2g;
(2)反应后所得溶液中溶质的质量分数为12.8%.
点评 根据质量守恒定律,反应后所得溶液的质量=参加反应金属的质量+加入的稀盐酸的质量-放出气体的质量,并掌握方程式计算的解题格式,溶质的质量分数的计算方法.

练习册系列答案
相关题目
13.用盐酸和酚酞混合液浸过的滤纸,若在滤纸上分别滴入下列溶液,滤纸上不会出现红色的是( )
| A. | 氯化钠溶液 | B. | 稀硫酸 | C. | 石灰水 | D. | 氢氧化钠 |
20.老年人骨质疏松,容易骨折,需要多摄入的常量元素是( )
| A. | 钙元素 | B. | 碘元素 | C. | 铁元素 | D. | 锌元素 |
10.下列物质的归类正确的是( )
| A. | 同一物质:火碱,纯碱,苛性钠 | B. | 复合肥料:氯化铵、磷矿粉、硝酸钾 | ||
| C. | 化石燃料:煤、石油、天然气 | D. | 混合物:氢气、石灰石、空气 |
14.中考前小明的午餐食谱是:主食--面包;配菜和副食--炸鸡腿、米饭、牛排、牛奶.则该午餐食谱缺乏的营养素是( )
| A. | 维生素 | B. | 脂肪 | C. | 蛋白质 | D. | 糖类 |
15.城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图: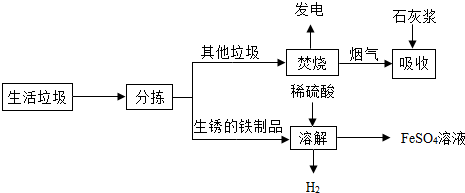
资料1:垃圾焚烧产生烟气中含有SO2、HCl等有害气体.
资料2:+2价的铁元素容易被空气中的氧气氧化.
回答下列问题:
(1)焚烧垃圾发电厂是将垃圾焚烧后获得的热能,最终转化为电能;
(2)在上述流程的“吸收”步骤中,石灰浆的作用是2HCl+Ca(OH)2═CaCl2+2H2O;(用其中任1个反应的化学方程式表示)
(3)在上述流程的“溶解”步骤中,发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有2个反应,其中有单质生成的化学方程式是Fe+H2SO4═FeSO4+H2↑;
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示:(仅在56.7℃或64℃温度下可同时析出两种晶体).
若需从硫酸亚铁溶液中结晶出FeSO4•4H2O,应控制的结晶温度(t)的范围为不超过64℃;
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它二种硫的氧化物,试写出该反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(7)请你就扬州市生活垃圾处理提一条建议生活垃圾分类回收等.

资料1:垃圾焚烧产生烟气中含有SO2、HCl等有害气体.
资料2:+2价的铁元素容易被空气中的氧气氧化.
回答下列问题:
(1)焚烧垃圾发电厂是将垃圾焚烧后获得的热能,最终转化为电能;
(2)在上述流程的“吸收”步骤中,石灰浆的作用是2HCl+Ca(OH)2═CaCl2+2H2O;(用其中任1个反应的化学方程式表示)
(3)在上述流程的“溶解”步骤中,发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有2个反应,其中有单质生成的化学方程式是Fe+H2SO4═FeSO4+H2↑;
(4)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,其中氮气的作用是保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4•7H2O、FeSO4•4H2O和FeSO4•H2O.硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示:(仅在56.7℃或64℃温度下可同时析出两种晶体).
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
(6)将无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和其它二种硫的氧化物,试写出该反应的化学方程式2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
(7)请你就扬州市生活垃圾处理提一条建议生活垃圾分类回收等.
 ⑤
⑤
