题目内容
15.下列物质中,属于纯净物的是( )| A. | 蔗糖 | B. | 黄酒 | C. | 白醋 | D. | 酱油 |
分析 物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素.
解答 解:A、蔗糖属于纯净物中的化合物,故选项正确;
B、黄酒属于酒精和水等,属于混合物,故选项错误;
C、白醋中有醋酸、水等,属于混合物,故选项错误;
D、酱油中有色素、氯化钠、水等物质,属于混合物,故选项错误;
故选A
点评 本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.

练习册系列答案
相关题目
5. 资料显示:镁与饱和碳酸氢钠溶液反应会产生大量气体和白色不溶物.某同学设计了如下实验方案,探究分析反应的产物.
资料显示:镁与饱和碳酸氢钠溶液反应会产生大量气体和白色不溶物.某同学设计了如下实验方案,探究分析反应的产物.
查阅资料知:①MgCO3和Mg(OH)2均为白色不溶物.
②酚酞遇碳酸氢钠溶液呈浅红色,酚酞遇碳酸钠溶液呈红色.
(1)提出假设:
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变成了红色.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能是MgCO3
猜测2:白色不溶物可能是Mg(OH)2
猜测3:白色不溶物可能是MgCO3和Mg(OH)2.
(2)设计实验确定产物并验证猜测:
(3)为进一步确定实验I的反应产物,又设计了如下实验方案(如图).
已知:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑
Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O
碱石灰可以吸收二氧化碳和水蒸气
①如图所示的实验装置C中碱石灰的作用是阻止空气中二氧化碳和水进入B中.
②称取实验Ⅰ中所得的干燥纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,请分析数据并结合实验Ⅱ、Ⅲ、Ⅳ的结论,该白色不溶物除含碳酸镁外还含有氢氧化镁Mg(OH)2,它们的质量比为84:29.
 资料显示:镁与饱和碳酸氢钠溶液反应会产生大量气体和白色不溶物.某同学设计了如下实验方案,探究分析反应的产物.
资料显示:镁与饱和碳酸氢钠溶液反应会产生大量气体和白色不溶物.某同学设计了如下实验方案,探究分析反应的产物.查阅资料知:①MgCO3和Mg(OH)2均为白色不溶物.
②酚酞遇碳酸氢钠溶液呈浅红色,酚酞遇碳酸钠溶液呈红色.
(1)提出假设:
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变成了红色.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能是MgCO3
猜测2:白色不溶物可能是Mg(OH)2
猜测3:白色不溶物可能是MgCO3和Mg(OH)2.
(2)设计实验确定产物并验证猜测:
| 实验序号 | 实验操作 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体为H2 |
| 实验Ⅲ | 取实验I中少量的白色不溶物,加入足量的稀盐酸 | 产生大量气泡 | 白色不溶物含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 澄清液中含有的溶质是碳酸钠(Na2CO3) |
已知:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2↑
Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O
碱石灰可以吸收二氧化碳和水蒸气
①如图所示的实验装置C中碱石灰的作用是阻止空气中二氧化碳和水进入B中.
②称取实验Ⅰ中所得的干燥纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,请分析数据并结合实验Ⅱ、Ⅲ、Ⅳ的结论,该白色不溶物除含碳酸镁外还含有氢氧化镁Mg(OH)2,它们的质量比为84:29.
3.学习化学可以了解日常生活中某些变化的本质,下列变化中属于化学变化的是( )
| A. | 木柴劈成块 | B. | 西瓜榨成汁 | C. | 高粱酿成酒 | D. | 残雪化成水 |
10.几年前,一辆载满20t电石的挂车,在浙江滨江区燃起熊熊大火并伴有大量黑烟.事故路面上洒落了五六百米燃着的石头.这辆货车在雨中整整燃烧了一天,消防官兵对大火也束手无措,场面让人震撼.大家对电石的化学性质产生了浓厚的兴趣,请你一起与他们完成下列探究活动.
【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟.
【猜想与假设】
电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.大家做出以上推断的依据是质量守恒定律反应前后元素的种类不变.大家讨论后一致认为该气体不可能是氧气,原因是氧气不具有可燃性,白色固体不可能是氧化钙,原因是(用化学方程式表示)CaO+H2O═Ca(OH)2.
【实验探究】
【反思交流】载有电石的货车可以在雨中整整燃烧一天而不熄灭,说明电石与水的反应是放热(填“吸热”或“放热”)反应.
【查阅资料】电石的主要成分是碳化钙(CaC2),可以与水反应生成一种可燃性气体及白色固体.常见的可燃性气体中,乙炔(C2H2)燃烧时伴有大量黑烟.
【猜想与假设】
电石与水反应生成的可燃性气体是:氧气、氢气或乙炔(C2H2);电石与水反应生成的白色固体是:氧化钙、氢氧化钙或碳酸钙.大家做出以上推断的依据是质量守恒定律反应前后元素的种类不变.大家讨论后一致认为该气体不可能是氧气,原因是氧气不具有可燃性,白色固体不可能是氧化钙,原因是(用化学方程式表示)CaO+H2O═Ca(OH)2.
【实验探究】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取适量电石加水反应,收集生成的气体,验纯后点燃. | 气体燃烧,产生黄色火焰并伴有浓烈黑烟. | 电石与水反应产生的气体是乙炔 |
| (2)取适量反应后生成的固体于试管中,滴加过量稀盐酸. | 固体溶解,没有气体产生. | 电石与水反应产生的固体不是碳酸钙 |
| (3)取适量反应后生成的固体于试管中加水,向上层清液中滴加2~3滴酚酞. | 溶液变红 | 电石与水反应产生的固体是氢氧化钙 |
20.蛋白质是人体必需的营养物质,它在人体内最终分解为( )
| A. | 葡萄糖 | B. | 维生素 | C. | 脂肪酸 | D. | 氨基酸 |
7.如表是KNO3、NaCl在不同温度下的溶解度(单位:g)
(1)40℃时,向100克水中加入70克KNO3晶体最终可得到饱和(“饱和”或“不饱和”)溶液.
(2)KNO3溶液中含有少量NaCl时,可通过降温结晶的方法提纯.析出的晶体和剩余溶液描述正确的是①(填写编号).
①剩余溶液一定是KNO3饱和溶液 ②剩余溶液一定是NaCl饱和溶液
③上述方法可以将两者完全分离 ④析出的晶体中不一定含有KNO3
(3)KNO3、NaCl在t℃时溶解度均为W克,则t的最可能范围是A
A.20<t<30 B.t=30 C.30<t<40 D.无法确定.
| 温度(℃) | 0 | 10 | 20 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(2)KNO3溶液中含有少量NaCl时,可通过降温结晶的方法提纯.析出的晶体和剩余溶液描述正确的是①(填写编号).
①剩余溶液一定是KNO3饱和溶液 ②剩余溶液一定是NaCl饱和溶液
③上述方法可以将两者完全分离 ④析出的晶体中不一定含有KNO3
(3)KNO3、NaCl在t℃时溶解度均为W克,则t的最可能范围是A
A.20<t<30 B.t=30 C.30<t<40 D.无法确定.
4.坚持绿色发展,构建生态昆山,下列做法不符合这一宗旨的是( )
| A. | 扩大公共绿地,打造绿色家园 | B. | 禁止秸杆焚烧,减轻雾霾影响 | ||
| C. | 发展公共交通,提倡低碳生活 | D. | 鼓励燃煤发电,保障电力供应 |
14.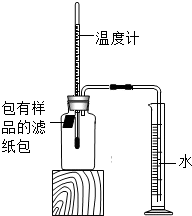 小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
(1)实验①和②说明NaCl可以加快铁锈蚀的速率.
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热 (填“放热”或“吸热”)过程.
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是Fe2O3•xH2O.
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成.
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是20.5%(小数点后保留1位).
 小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.| 序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
| 1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
| 2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
| 3 | 1g铁粉、10滴水 | 100 | 70 | 约480 |
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热 (填“放热”或“吸热”)过程.
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是Fe2O3•xH2O.
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成.
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是20.5%(小数点后保留1位).