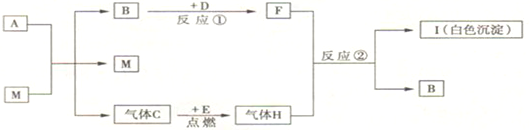
题目内容
8.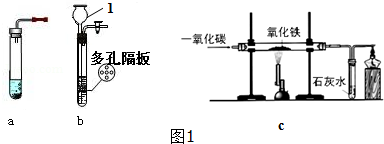 如图1所示装置制取氢气,试回答下列问题:
如图1所示装置制取氢气,试回答下列问题:(1)仪器1的名称长颈漏斗.
(2)与a比较,b装置的优点是可以控制反应开停.
(3)检查b装置气密性的方法是关闭活塞,向长颈漏斗中加水,液面不下降
不用填.
(4)一氧化碳和氢气都具有还原性,c图中是一氧化碳还原氧化铁,反应前应先通一氧化碳,再点燃酒精喷灯,一段时间后,可以观察到硬质玻璃管内红色粉末变黑,请写出其化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.在装置末端酒精灯的作用是尾气处理.
(5)若b装置气密性良好,某同学用排水法收集一试管氢气,检验时,听到尖锐爆鸣声,发现收集的氢气不纯,请写出实验室制取氢气的化学方程式Zn+H2SO4=ZnSO4+H2↑.
(6)b装置除了能用于制取氢气外,还能用于制取CO2(填一种即可),请写出制取这种气体的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
(7)如图2所示A、B、C、D四套装置中,哪些可以产生与图1中b装置相同的效果?BD(填编号).

分析 (1)根据实验室常用仪器的名称和题中所指仪器的作用进行分析;
(2)根据b装置可以通过气体的压强,使固体和液体分离进行分析;
(3)根据检验装置气密性的正确操作进行分析;
(4)根据一氧化碳还原氧化铁时,反应前应先通一氧化碳,再点燃酒精喷灯,防止一氧化碳和空气的混合气点燃发生爆炸,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,一氧化碳有毒进行分析;
(5)根据用排水法收集一试管氢气,检验时,听到尖锐爆鸣声,发现收集的氢气不纯,锌和稀硫酸反应生成硫酸锌和氢气进行分析;
(6)根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
(7)根据题中所给装置的反应原理进行分析.
解答 解:(1)通过分析题中所指仪器的作用可知,1是长颈漏斗;
(2)b装置可以通过气体的压强,使固体和液体分离,所以优点是:可以控制反应开停;
(3)检查b装置气密性的方法是:关闭活塞,向长颈漏斗中加水,液面不下降;
(4)一氧化碳还原氧化铁时,反应前应先通一氧化碳,再点燃酒精喷灯,防止一氧化碳和空气的混合气点燃发生爆炸,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,可以观察到硬质玻璃管内红色粉末变黑,化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,一氧化碳有毒,所以在装置末端酒精灯的作用是尾气处理;
(5)用排水法收集一试管氢气,检验时,听到尖锐爆鸣声,发现收集的氢气不纯,锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;
(6)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,所以b装置除了能用于制取氢气外,还能用于制取CO2,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(7)通过分析各装置的反应原理,A、C装置不会通过压强的变化是固体和液体分离,B、D通过压强的变化是固体和液体分离,故选:BD.
故答案为:(1)长颈漏斗;
(2)可以控制反应开停;
(3)关闭活塞,向长颈漏斗中加水,液面不下降;
(4)一氧化碳,点燃酒精喷灯,红色粉末变黑,Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,尾气处理;
(5)尖锐爆鸣声,Zn+H2SO4=ZnSO4+H2↑;
(6)CO2,CaCO3+2HCl=CaCl2+H2O+CO2↑;
(7)BD.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 颜色的改变 | B. | 气体放出 | C. | 新物质生成 | D. | 发光、放热现象 |
| A. | 第一次反应停止后,B剩余9g | B. | 第二次反应后,C的质量为10g | ||
| C. | 反应中A和B的质量比为3:2 | D. | 第二次反应消耗的C的质量为4g |
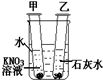 如图所示,在盛冷水烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是( )
如图所示,在盛冷水烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是( )| A. | 氯化钠 | B. | 硝酸钾 | C. | 硝酸铵 | D. | 氢氧化钾 |
 图中A、B、C、D、E、F为九年级化学中常见的六种物质,这六种物质之间的部分反应及转化关系如右图 所示.蓝色溶液A与C反应能生成两种沉淀,B为氧化物,C、D、E、F分别是碳酸钠溶液、稀硫酸、氢氧化钡溶液和氢氧化钠溶液中的一种,E中溶质可用于生产洗涤剂.用“→”表示一种物质能转化为另一种物质,用两圆相切或“-”表示两种物质可以发生化学反应.
图中A、B、C、D、E、F为九年级化学中常见的六种物质,这六种物质之间的部分反应及转化关系如右图 所示.蓝色溶液A与C反应能生成两种沉淀,B为氧化物,C、D、E、F分别是碳酸钠溶液、稀硫酸、氢氧化钡溶液和氢氧化钠溶液中的一种,E中溶质可用于生产洗涤剂.用“→”表示一种物质能转化为另一种物质,用两圆相切或“-”表示两种物质可以发生化学反应.