题目内容
3.某地产石灰石中所含的杂质不溶于水,也不和盐酸反应.为测定该石灰石中碳酸钙的含量,现进行下列实验:称取25g石灰石放在质量为145g的烧杯中,向其中加入100g稀盐酸,反应恰好完全,这时称得烧杯和其中物质质量共为261.2g.求:①反应中生成二氧化碳气体的质量?
②该石灰石中碳酸钙的质量分数?
③所得溶液中溶质的质量分数?
分析 根据质量守恒定律,烧杯及其中物质减少的质量就是生成的二氧化碳的质量,由二氧化碳的质量,根据碳酸钙与盐酸反应的方程式可求出碳酸钙、氯化钙的质量,由以上数据就可以进行有关的计算.
解答 解:①由题意可知,反应中生成的二氧化碳的质量为:25g+145g+100g+100g-261.2g=8.8g;
②设25g石灰石中碳酸钙的质量为x,反应生成氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 8.8g
$\frac{100}{x}=\frac{111}{y}=\frac{44}{8.8g}$ 解得:x=20g,y=22.2g
石灰石中碳酸钙的质量分数为$\frac{20g}{25g}$×100%=80.0%
③反应后溶液中溶质的质量分数为:$\frac{22.2g}{20g+100g-8.8g}$×100%=20.0%
答:①反应中生成二氧化碳气体的质量是8.8g;②石灰石中碳酸钙的质量分数是80.0%,③反应后溶液中溶质的质量分数是20.0%
点评 本题主要考查学生运用质量守恒定律和化学方程式进行计算的能力,难度不大,计算时要注意规范性和准确性.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
13.列相关说法用粒子的知识解释错误的是
( )
| 相关说法 | 解释 | |
| A | “遥知不是雪,为有暗香来”中的“暗香来” | 分子不断运动 |
| B | 工业制氧气过程中能把空气加压成液态 | 分子之间有间隔 |
| C | 盐酸、硫酸溶液显酸性 | 溶液中都含有酸根离子 |
| D | 一氧化碳和二氧化碳化学性质不同 | 分子构成不同 |
| A. | A | B. | B | C. | C | D. | D |
14.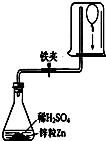 为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
①甲烷 ②氧气 ③氨气 ④氯气.
 为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( ) ①甲烷 ②氧气 ③氨气 ④氯气.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
18.下列变化中,前者是物理变化,后者是化学变化的是( )
| A. | 海水晒盐食物腐烂 | B. | 蜡烛燃烧铁生锈 | ||
| C. | 汽油挥发工业上制氧气 | D. | 甘蔗榨汁干冰升华 |
15.由硫酸钠和硫酸钙组成的混合物中,测知氧元素的质量分数为46%.若再计算混合物中的下列各项:①硫元素的质量分数 ②钠元素的质量分数 ③硫酸钙的质量分数 ④硫酸钠的质量 ⑤硫酸钠和硫酸钙的质量比 ⑥钙元素和钠元素的总质量;以下判断正确的是( )
| A. | 都能确定 | B. | 都不能确定 | ||
| C. | 除④和⑥外都能确定 | D. | 只有①和⑤能确定 |
12.生铁是铁和碳的合金.为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入100.0g稀硫酸,恰好完全反应.测得的实验数据如下:
计算:(1)生铁样品中铁的质量分数是多少?(2)所用稀硫酸的溶质质量分数?
| 反应前 | 反应后 | |
| 烧杯及其中物质的质量 | 136.0g | 135.8g |
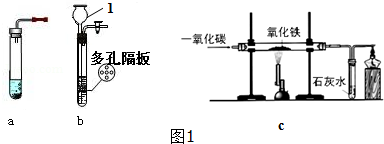 如图1所示装置制取氢气,试回答下列问题:
如图1所示装置制取氢气,试回答下列问题:
 我们已经知道.空气的主要成分是氮气和氧气.下图是测定空气中氧气含量的实验装置.试回答下列问题:
我们已经知道.空气的主要成分是氮气和氧气.下图是测定空气中氧气含量的实验装置.试回答下列问题: