题目内容
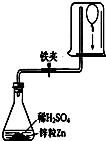
19.分别把铁和铜投入到稀硫酸中,有产生气泡的是铁,没有发生反应的是铜,写出有发生反应的化学方程式Fe+H2SO4═FeSO4+H2↑,该反应类型是置换反应.分析 根据在金属活动性顺序中,氢前的金属能与酸反应生成氢气进行分析.
解答 解:在金属活动性顺序中,铁>氢>铜,所以铁能与硫酸反应生成氢气,铜不能与硫酸反应生成氢气,铁和硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4═FeSO4+H2↑,该反应属于置换反应.
故答案为:铁,铜,Fe+H2SO4═FeSO4+H2↑,置换反应.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目
14. 为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
①甲烷 ②氧气 ③氨气 ④氯气.
 为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( )
为测定气球内的气体成分,有学生用超薄材料制成的气球按如图装置进行实验.开始时气球浮于烧杯底部,打开快夹后,过一会儿气球从烧杯底部慢慢下降.气球内可能的气体是( ) ①甲烷 ②氧气 ③氨气 ④氯气.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
4.在天平两端各放一个盛有200g18.25%盐酸的小烧杯,调节天平平衡,分别向两烧杯中加入下列各组物质充分反应后天平仍保持平衡的是( )
| A. | 18gMg、18gCu | B. | 20gCaO、20gCaCO3 | ||
| C. | 10gAgNO3溶液、5gCu(OH)2 | D. | 4gMg(OH)2、8.4gMgCO3 |
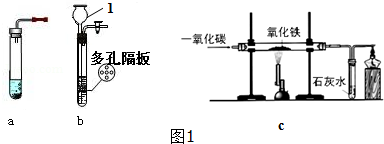 如图1所示装置制取氢气,试回答下列问题:
如图1所示装置制取氢气,试回答下列问题: