题目内容
10.现有①氧气②二氧化碳③氮气④稀有气体四种物质,请用各物质的序号填空.(1)体积约占空气体积的78%,是工业上生产硝酸和化肥的重要原料的是③;
(2)人类维持生命不可缺少的气体是③,燃料燃烧也离不开它;
(3)虽然④几乎不与任何物质发生化学反应,但是也有很广泛的用途,如制造电光源等;
(4)②是植物进行光合作用不可缺少的物质.
分析 根据空气中各成分的体积分数以及各成分的性质和用途进行分析解答即可.
解答 解:空气中含量最多的两种气体是氮气和氧气,氮气大约占78%、氧气大约占21%;氮气的化学性质不活泼,制造氮肥、氮气充入食品包装袋内可以防腐、液态氮可以做制冷剂;
空气中维持人类生命活动的气体是氧气;稀有气体化学性质稳定,通电发光,可以用于制作电光源;二氧化碳是植物进行光合作用不可缺少的物质;
故答案为:(1)③;(2)③;(3)④:(4)②.
点评 本考点考查了空气中各种气体的含量和气体的用途,同学们要加强记忆有关的知识点,在理解的基础上加以应用,本考点基础性比较强,主要出现在选择题和填空题中.

练习册系列答案
相关题目
20.我国最近已研究出新型水处理剂C1O2的新制法,其反应的微观过程如图所示.下列说法正确的是( )


| A. | 乙、丙、丁都是混合物 | |
| B. | 该反应属于置换反应 | |
| C. | 该反应符合质量守恒定律 | |
| D. | 该反应的化学方程式为2Cl+2NaClO2=2ClO2+2NaCl |
18.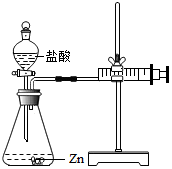 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
5.物质的用途和性质密切相关.下列用途主要是利用其化学性质的是( )
| A. |  铜丝作导线 | B. |  氢气作高能燃料 | ||
| C. |  新材料制成隔水透气鸟笼 | D. |  生铁制成铁锅 |
 化学概念间有包含、并列、交叉等不同关系.下列选项符合如图所示关系的是( )
化学概念间有包含、并列、交叉等不同关系.下列选项符合如图所示关系的是( )