题目内容
18. 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】
a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈).
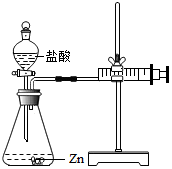
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积判断生成氢气的体积.所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响固体的表面积(写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为8(b-a)g.
分析 【设计探究】金属与酸的反应为置换反应,写出反应的化学方程式;根据现象得出结论;
得出结论:根据金属的活动性顺序,分析金属的活动性与反应的剧烈程度的关系;
实验(2)根据注射器的作用是量取生成气体的体积解答;
得出结论:根据表中信息结合浓度对反应的影响分析解答;
【反思评价】根据表中信反应的剧烈程度与酸的浓度有关,结合反应的过程进行分析;根据控制变量法结合影响反应速率的因素进行设计实验;
【拓展延伸】根据反应前后固体的质量增加求出生成铜的质量即可.
解答 解:【设计探究】由题意知:反应物、生成物,根据质量守恒定律,正确书写化学方程式,铁与盐酸反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;锌与盐酸反应的化学方程式为:Zn+2HCl=ZnCl2+H2↑;放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,因此金属活动性强弱为:Zn>Fe;
得出结论:金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈);
实验(2)注射器的作用是通过注射器往右移动的体积判断生成氢气的体积;
得出结论:根据表格信息可知,其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】锌与盐酸反应产生气体的速度先加快后变慢,因为锌与盐酸是放热反应,所以开始时温度升高,产生气体速度加快,随着反应的进程,盐酸不断被消耗,浓度降低,产生气体速度变慢.
金属与盐酸反应的剧烈程度可能受固体的表面积、反应物的状态、催化剂的影响;
【拓展延伸】设生成Cu的质量为m,则:
Fe+CuSO4=Cu+FeSO4 质量增加△m
56 64 8
ag m (b-a)g
$\frac{64}{m}=\frac{8}{(b-a)g}$
m=8(b-a)g
故答案为:【设计探究】Fe+2HCl=FeCl2+H2↑、Zn+2HCl=ZnCl2+H2↑;>;
金属与盐酸反应的剧烈程度与金属本身性质有关(金属活动性越强,反应越剧烈);
实验(2)通过注射器往右移动的体积判断生成氢气的体积;
得出结论:其他条件相同时,盐酸浓度越大,反应越剧烈;
【反思评价】由慢到快然后逐渐减慢;锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.固体的表面积;
【拓展延伸】8(b-a)g.
点评 本考点主要考查了影响金属与酸发生化学反应速率的因素的探究,还考查了在生产、生活及实验中应注意的问题.从酸的浓度、金属的活动性和金属的状态等不同的角度,设计实验,也考查了学生的实验设计能力.要认真分析,综合把握,问题就会迎刃而解.本考点主要出现在实验题中.

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铜外,氧化铁也可作氯酸钾分解的催化剂.
【完成实验】按下表进行实验并获得相关数据(分解温度越低,催化效果越好).
| 实验编号 | 实验药品 | 分解温度(℃) |
| A | 氯酸钾 | 580 |
| B | 氯酸钾、二氧化锰(质量比1:1) | 350 |
| C | 氯酸钾、氧化铜(质量比l:1) | 370 |
| D | 氯酸钾、氧化铁(质量比1:1) | 390 |
(2)实验所用的三种金属氧化物,催化效果最好的是二氧化锰.
【反思】(1)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证可将氯酸钾与不同颗粒大小的同种催化剂等比充分混合,测定加热分解温度即可.
(2)同种催化剂,还有哪些因素可能影响催化效果?催化剂与反应物的质量比不同(提出一种因素即可).
| A. | 空气是一种宝贵的资源,其中含量最多的物质是氮气 | |
| B. | 生物细胞中含量最多的元素是钙元素 | |
| C. | 地壳中含量最多的金属元素是硅元素 | |
| D. | 地球上的淡水很少,可利用的淡水更少,可利用的淡水约占全球储水量的2.53% |
| A.物质的分类 | B.化学家及其杰出贡献 |
| ①氧化物中均含有氧元素 ②混合物中一定含有多种元素 ③合成橡胶、合金都属于合成材料 | ①张青莲----测量相对原子质量 ②拉瓦锡----最早发现氧气 ③侯德榜----发明联合制碱法 |
| C.能量变化 | D.用“化学”眼光分析 |
| ①电解水是将电能转化成化学能 ②煤燃烧是将化学能转化成热能 ③在化学反应中只有燃烧才能放出热量 | ①洗涤剂去油污-是乳化作用 ②湿衣服晾干是因为分子在不停的运动 ③明矾净水是因为明矾溶于水生成胶状物 |
| A. | A | B. | B | C. | C | D. | D |



 根据如图所示仪器回答:
根据如图所示仪器回答: