题目内容
14.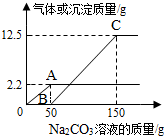 在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.(1)用化学方程式表示OA段产生气体的原因Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
(2)实验时从开始产生沉淀到反应结束所用碳酸钠溶液的质量为100g.
(3)利用生成沉淀的反应求碳酸钠溶液中碳酸钠的质量分数为10.6%(写出计算过程).
(4)当反应到C点时溶液中的溶质质量为21.3克.
分析 锌和稀硫酸反应生成硫酸锌和氢气,碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,碳酸钠和硫酸锌反应生成碳酸锌沉淀和硫酸钠,根据反应的化学方程式和提供的数据可以进行相关方面的计算和判断.
解答 解:(1)OA段产生气体,是因为锌和稀硫酸反应时稀硫酸过量,过量的稀硫酸和碳酸钠反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
(2)实验时从开始产生沉淀到反应结束所用碳酸钠溶液的质量为:150g-50g=100g,
故填:100.
(3)设100g碳酸钠溶液中碳酸钠质量为x,
Na2CO3+ZnSO4═Na2SO4+ZnCO3↓,
106 125
x 12.5g
$\frac{106}{x}$=$\frac{125}{12.5g}$,
x=10.6g,
碳酸钠溶液中碳酸钠的质量分数为:$\frac{10.6g}{100g}$×100%=10.6%,
故填:10.6%.
(4)由Na2CO3+H2SO4═Na2SO4+H2O+CO2↑、Na2CO3+ZnSO4═Na2SO4+ZnCO3↓可知Na2CO3~Na2SO4,因此当反应到C点时溶液中的溶质是硫酸钠,
设硫酸钠质量为y,
Na2CO3~Na2SO4,
106 142
150g×10.6% y
$\frac{106}{150g×10.6%}$=$\frac{142}{y}$,
y=21.3g,
故填:21.3.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

 阅读快车系列答案
阅读快车系列答案| 烧杯序号 | 温度/℃ | 水的质量/g | 氯化铵质量/g | 溶液质量/g |
| ① | 20 | 100 | 20 | a |
| ② | 20 | 100 | 40 | 137.2 |
| ③ | 40 | 100 | 40 | 140 |
| ④ | 60 | 100 | 50 | 150 |
(2)将烧杯①所得溶液稀释成溶质质量分数为10%的溶液,需要加水80g;
(3)上述烧杯中的溶液不能确定是否达到饱和状态的是③④(填序号);
(4)若将烧杯②中溶液升温到40℃(不考虑水的蒸发),下列各量一定变大的是ACD.
A.溶质质量 B.溶剂质量 C.溶解度 D.溶质的质量分数.
| A. | 氟乙酸甲酯属于氧化物 | |
| B. | 氟乙酸甲酯中碳元素的质量分数约为39.1% | |
| C. | 氟乙酸甲酯分子是由3个碳原子、5个氢原子、1个氟原子、2个氧原子构成的 | |
| D. | 氟乙酸甲酯中碳、氢、氟、氧四种元素的原子个数比为36:5:19:32 |


 A、B、C三种物质的溶解度曲线(见图),请根据此图回答下列问题:
A、B、C三种物质的溶解度曲线(见图),请根据此图回答下列问题: 自行车作为常用的代步工具,既轻便灵活,又符合环保要求,如图是一款自行车的示意图.
自行车作为常用的代步工具,既轻便灵活,又符合环保要求,如图是一款自行车的示意图.