题目内容
4.某班同学在粗盐提纯实验中,为把难溶性杂质(泥沙等)和少量可溶性杂质CaCl2、MgCl2一并除去,设计如图实验方案,请据此回答问题:
(1)实验操作A的名称是过滤,该操作的目的是除去泥沙等难溶性杂质.
(2)写出步骤③中发生反应的主要化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;步骤⑥的作用是除去过量的氢氧化钠和碳酸钠.
(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氮化钠要多,请你为他找出理由:因为在实验过程中有氯化钠生成.
分析 (1)根据过滤操作的目的,过滤可以将固体和液体分离;
(2)根据要求正确书写化学方程式,步骤⑥加适量稀盐酸的作用是除去过量的氢氧化钠和碳酸钠;
(3)根据实验过程中各步反应的生成物进行分析.
解答 解:(1)过滤可以将固体和液体分离,从溶液中得到固体需要进行蒸发,所以实验操作A的名称是过滤,该操作的目的是除去难溶性杂质;故填:过滤;除去泥沙等难溶性杂质;
(2)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
步骤⑥加适量稀盐酸的作用是除去过量的氢氧化钠和碳酸钠;
故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;除去过量的氢氧化钠和碳酸钠;
(3)因为在实验过程中有氯化钠生成,所以该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多.故填:因为在实验过程中有氯化钠生成.
点评 本题涉及除杂、化学方程式的书写等方面的知识,难度适中,是综合性题目.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
19.如图所示的实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列实验现象不正确的是( )
| A. | 铁丝在氧气中燃烧时,火星四射、生成黑色固体 | |
| B. | 木炭在氧气中燃烧时,发出红光 | |
| C. | 镁条在空气中燃烧时,发出耀眼的白光 | |
| D. | 硫磺在空气中燃烧时,产生淡蓝色的火焰 |
16.某同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂.因此,他停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行了如下探究,请你和他一起完成探究活动.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙;
猜想二:可能是CaCl2和Ca(OH)2;
猜想三:含有HCl和CaCl2.
【查阅资料】氯化钙溶液呈中性.
【方案设计】
【方案评价】该同学与同学们通过讨论认为:
(1)方案一能证明猜想二正确,但不能证明猜想一正确.
(2)方案二可行.但该同学在记录时未记录完整,请你帮他将方案二补充完整.
【方案反思】方案一不能证明猜想一正确的理由是酚酞不变色还可能是含有盐酸和氯化钙.
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是向废液中加入碳酸钙,当不再产生气泡时,停止加入碳酸钙,过滤即得只含有氯化钙的废液.
【结论】在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否过量.
【提出问题】溶液中的溶质是什么物质?
【作出猜想】猜想一:溶质只有氯化钙;
猜想二:可能是CaCl2和Ca(OH)2;
猜想三:含有HCl和CaCl2.
【查阅资料】氯化钙溶液呈中性.
【方案设计】
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 方案一 | 取少量烧杯内的溶液于试管中, 滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
| 酚酞变红色 | 猜想二正确 | ||
| 方案二 | 取少量烧杯内的溶液于试管中, 逐滴加入碳酸钠溶液至过量 | 先有气泡冒出,然后会有沉淀 | 猜想三正确 |
(1)方案一能证明猜想二正确,但不能证明猜想一正确.
(2)方案二可行.但该同学在记录时未记录完整,请你帮他将方案二补充完整.
【方案反思】方案一不能证明猜想一正确的理由是酚酞不变色还可能是含有盐酸和氯化钙.
【拓展与应用】实验证明猜想三是正确的.要想使溶液中的溶质只有氯化钙,你认为应该进行的实验步骤是向废液中加入碳酸钙,当不再产生气泡时,停止加入碳酸钙,过滤即得只含有氯化钙的废液.
【结论】在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否过量.
13. 化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡冒出
证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3,贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】贝贝为了验证自己的猜想,进行了如表实验,请你补充完整.
【实验反思】同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是排除因硫酸的加入,稀释氢氧化钠溶液而引起pH减小因素的干扰.
 化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.
化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.探究一:二氧化碳是否与氢氧化钠发生了化学反应?同学们取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡冒出
证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3,贝贝认为溶质是Na2CO3和NaOH
【查阅资料】CaCl2溶液呈中性
【实验验证】贝贝为了验证自己的猜想,进行了如表实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量酚酞 | ①产生白色沉淀 ②溶液变红 | 贝贝的猜想成立 |
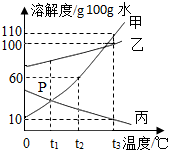 如图为甲、乙、丙三种固体物质溶解度曲线,据图回答:
如图为甲、乙、丙三种固体物质溶解度曲线,据图回答: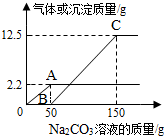 在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.