题目内容
2.用离子符号、化学式或化学方程式按下列要求填空:(1)(填离子符号)硫酸钠中的阴离子SO42-;氯化亚铁中的阳离子Fe2+.
(2)(填化学式)能使木材、纸张变黑的酸H2SO4;SO2气体的大量排放会形成酸雨;Ca(OH)2可以被用来改良酸性土壤.
(3)(填化学方程式)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.铁丝在氧气中燃烧的现象是剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,由生灰石制备熟石灰的化学方程式为CaO+H2O═Ca(OH)2.
分析 (1)硫酸钠中的阴离子是硫酸根离子,氯化亚铁中的阳离子是亚铁离子,写出其离子符合即可.
(2)首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.
(3)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)硫酸钠中的阴离子是硫酸根离子,其离子符号为:SO42-.
氯化亚铁中的阳离子是亚铁离子,其离子符号为:Fe2+.
(2)浓硫酸具有脱水性,能使木材、纸张变黑,其化学式为:H2SO4.
二氧化硫气体的大量排放会形成酸雨,其化学式为:SO2.
氢氧化钙具有碱性,属于碱,可用于改良酸性土壤,其化学式为:Ca(OH)2.
(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体;反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
故答案为:(1)SO42-;Fe2+;
(2)H2SO4;SO2;Ca(OH)2;
(3)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体;3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
CaO+H2O═Ca(OH)2.
点评 本题难度不大,掌握常见化学用语(化学式、化学方程式、离子符号等)的书写方法等是正确解答此类题的关键.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 氢气 | B. | 煤 | C. | 石油 | D. | 天然气 |
【查阅资料】
(1)金属与酸发生置换反应,其本质是金属单质与H+反应.
(2)生产H2速率主要取决于:①金属的表面积 ②溶液中H+浓度 ③温度等条件.
(3)H+的浓度与1L溶液中H+数目成正比.
(4)溶液中除H+外的其它离子可能会影响反应速率.
【提出问题】
①小丹同学在进行上述实验时,控制了镁带与酸反应的哪几个条件?(回答两条即可)金属的表面积,溶液中H+浓度;
②上述反应中Cl-、SO42-如何影响反应速率?
【猜想假设】
Ⅰ、Cl-促进了镁与酸的反应,SO42-对反应无影响.
Ⅱ、SO42-抑制了镁与酸的反应,Cl-对反应无影响.
Ⅲ、硫酸根抑制了镁与酸的反应,氯离子加速了镁与酸的反应.
请回答问题①,完成猜想Ⅲ.
【实验探究】
为了证明猜想,小丹设计了如下实验:
| 实验编号 | 铝片长度 | H+浓度相同的酸 | 反应片刻后添加少量试剂 | 产生气泡的速率 | 结论 |
| A | 2cm | 5mL | Na2SO4固体 | 无明显变化 | (结论A) |
| B | 2cm | 5mL | (试剂B) | 明显变快 | Cl-对反应有促进作用 |
【结论】
结论A为钠离子、硫酸根离子对反应无影响.
【反思】
将试剂B改用HCl气体,不能达到实验目的,其原因是通入HCl气体时,形成盐酸增加了氢离子的浓度,改变了实验的条件.
| A. | 救援“东方之星”沉船时携带氧气瓶,说明吸氧为人体呼吸提供了适量的氧气 | |
| B. | 木炭在氧气中燃烧发出蓝紫色火焰 | |
| C. | 氧气用于炼钢是利用了氧气能支持燃烧 | |
| D. | 氧气和臭氧(O3)都是由氧元素形成的单质 |
| A. | 纸张燃烧玻璃破碎 | B. | 海水蒸发苹果腐烂 | ||
| C. | 百炼成钢菜刀生锈 | D. | 滴水成冰汽油挥发 |
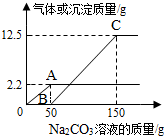 在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.
在实验课上,同学们用锌和稀硫酸反应制取氢气.小明取反应后的溶液164.7g,滴入碳酸钠溶液,有气体和白色沉淀生成.加入碳酸钠溶液与生成沉淀或气体的质量关系如图.