题目内容
5.某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图1所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.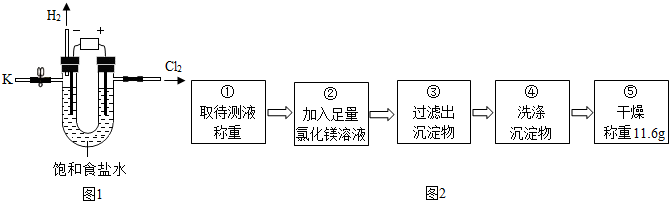
I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
分析 I.根据反应物、生成物,写出电解饱和食盐水的化学方程式;
(1)氢氧化钠溶液显碱性,能使酚酞试液变红色;
(2)氢氧化钠和稀盐酸反应生成氯化钠和水;
(3)向氢氧化钠溶液中滴加稀盐酸时,溶液的碱性减弱,pH减小,当pH=7时,氢氧化钠和稀盐酸恰好完全反应;
(4)为了使氢氧化钠溶液中的氢氧化钠和氯化镁完全反应,氯化镁溶液应该是足量的;
(5)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,因此步骤③过滤出的沉淀物是氢氧化镁;根据化学方程式进行计算;
(6)利用沉淀物的质量计算氢氧化钠的质量分数时,若不洗涤沉淀,那么沉淀上会附着一些杂质,从而使沉淀的质量增大,会导致计算出的氢氧化钠质量偏大,使所测定氢氧化钠的质量分数偏大.
解答 解:I.电解饱和食盐水的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(1)实验步骤:向待测液中滴加几滴酚酞试液;实验现象:酚酞试液变红色;实验结论:待测液中含有氢氧化钠;
(2)氢氧化钠与稀盐酸反应的化学方程式为:NaOH+HCl═NaCl+H2O;
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量时,应选用稀盐酸的体积为9.8mL,因为这时氢氧化钠和稀盐酸恰好完全反应;还缺少的一个数据是稀盐酸的密度.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应;滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量.
(5)步骤③过滤出的沉淀物是氢氧化镁,则设氢氧化钠的质量为x.
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
80 58
x 11.6g
则$\frac{80}{58}=\frac{x}{11.6g}$,解得x=16g.
故氢氧化钠溶液的质量分数为:$\frac{16g}{100g}×100%$=16%.
(6)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,沉淀中因含有其他杂质而质量偏大,所测定氢氧化钠的质量分数将偏大.
故答案为:
I.2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(1)向待测液中滴加几滴酚酞试液;酚酞试液变红色;(2)NaOH+HCl═NaCl+H2O;(3)9.8;
(4)使氢氧化钠完全反应;取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量;
(5)16%;(6)偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

 金博士一点全通系列答案
金博士一点全通系列答案| A. | 青蒿素属于有机物 | |
| B. | 青蒿素分子中碳、氢、氧的原子个数比为15:22:5 | |
| C. | 青蒿素的相对分子质量282g | |
| D. | 青蒿素由碳、氢、氧三种元素组成 |
 生活中常用的清洗剂.
生活中常用的清洗剂.| 名称 | 洁厕灵 | 炉具清洁剂 | 高效去污粉 | 消毒液 |
| 产品 样式 |  |  |  |  |
| 有效成分 | 盐酸 | 氢氧化钠 | 碳酸钠 | NaCl和NaClO |
(2)高效去污粉中加入足量的洁厕灵,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+CO2↑+H2O.
(3)消毒液成分中,NaClO中 Cl元素的化合价为+1价.工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,该反应的化学方程式为2NaOH+Cl2 ═NaCl+NaClO+H2O.
| A. | 硫在氧气中燃烧产生淡蓝色火焰 | B. | 铁锈与稀盐酸反应溶液变成浅绿色 | ||
| C. | 镁条和稀盐酸反应放出大量的热 | D. | 碳还原氧化铜生成铜 |
 ”表示氧原子、“
”表示氧原子、“ ‘’表示氢原子.仔细观察下图,回答下列问题:
‘’表示氢原子.仔细观察下图,回答下列问题:
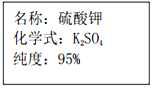 一包钾肥的包装袋上的部分内容如图所示,为确定该化肥纯度(即K2SO4的质量分数)是否符合包装袋上的说明,称取20g样品,加入适量水溶解后,再加入足量的Ba(NO3)2溶液充分反应,得到23.3gBaSO4.通过计算确定该化肥纯度是否符合包装袋上的说明.(假设化肥中杂质不与Ba(NO3)2溶液反应,反应的化学方程式是Ba(NO3)2+K2SO4═BaSO4↓+2KNO3)
一包钾肥的包装袋上的部分内容如图所示,为确定该化肥纯度(即K2SO4的质量分数)是否符合包装袋上的说明,称取20g样品,加入适量水溶解后,再加入足量的Ba(NO3)2溶液充分反应,得到23.3gBaSO4.通过计算确定该化肥纯度是否符合包装袋上的说明.(假设化肥中杂质不与Ba(NO3)2溶液反应,反应的化学方程式是Ba(NO3)2+K2SO4═BaSO4↓+2KNO3)