题目内容
14.取8.0g氧化铜加人稀硫酸并微热,待氧化铜全部反应完,共用去稀硫酸100.0g.(1)反应中观察到的现象氧化铜逐渐消失,溶液由无色逐渐变为蓝色;
(2)计算实验所用稀硫酸的溶质质量分数.
分析 (1)根据氧化铜与稀硫酸的反应分析回答实验的现象;
(2)根据氧化铜的质量求出稀硫酸中溶质的质量,再根据溶质的质量分数计算即可.
解答 解:(1)氧化铜能与稀硫酸反应生成了硫酸铜和水,现象是:氧化铜逐渐消失,溶液由无色逐渐变为蓝色;
(2)设所用稀硫酸的溶质质量为x
CuO+H2SO4═CuSO4+H2O
80 98
8.0g x
$\frac{80}{98}=\frac{8.0g}{x}$ 解得:x=9.8g
实验所用稀硫酸的溶质质量分数是:$\frac{9.8g}{100.0g}×100%$=9.8%.
故答为:(1)氧化铜逐渐消失,溶液由无色逐渐变为蓝色;(2)实验所用稀硫酸的溶质质量分数是9.8%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
4. 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )| A. | 乙醇是由三种元素组成的化合物 | B. | 一个乙醇分子中含有26个质子 | ||
| C. | 乙醇中碳、氧元素的质量比为2:1 | D. | 乙醇中碳元素的质量分数最大 |
5.某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图1所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.
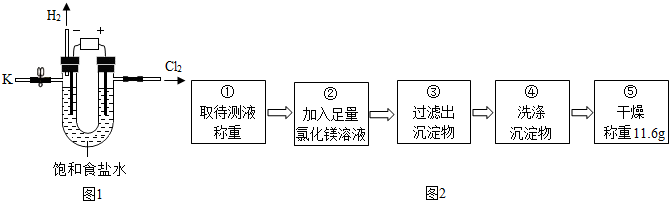
I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
【探究活动二】测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
(2)写出氢氧化钠与稀盐酸反应的化学方程式:NaOH+HCl═NaCl+H2O.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).

I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
17.锂电池是新型的高能电池,其质量轻、电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应可表示为Li+MnO2→LiMnO2,以下说法不正确的是( )
| A. | 该反应属于化合反应 | |
| B. | 该反应中Li元素的化合价发生了改变 | |
| C. | LiMnO2属于氧化物 | |
| D. | 锂电池板是化学能转化为电能装置 |
18.为测定某石灰石样品中碳酸钙的含量,称取该样品进行实验,发生反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑,经过多次实验后,得出如下数据(平均值):
求:(1)根据质量守恒定律,生成二氧化碳质量为8.80g.
(2)该大理石样品中含碳酸钙的质量分数(要求写出计算过程).
| 反应前 | 充分反应后装置及反应剩余物质的质量 | |
| 装置及稀盐酸的质量 | 大理石样品的质量 | |
| 342.10g | 36.00g | 369.30g |
(2)该大理石样品中含碳酸钙的质量分数(要求写出计算过程).
