题目内容
16.高锰酸钾是一种常用的化学试剂.(1)电解K2MnO4溶液可获得高锰酸钾(反应Ⅰ)的化学方程式为:
2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2X,反应Ⅰ中,X的化学式为KOH.
(2)高锰酸钾制取氧气 (反应Ⅱ) 的化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑
KMnO4相对分子质量为158,若取 15.8g KMnO4充分受热分解,产生 O2的质量最多为1.6 g;
(3)科研小组重复进行高锰酸钾分解实验,测得产生 O2的质量大于通过“反应Ⅱ”化学方程式计算得到的结果.某同学据此提出如下猜测:①加热时,高锰酸钾中的钾、锰元素转化为氧元素并释放氧气;②加热时,K2MnO4将进一步分解并释放出氧气;③加热温度不同时,高锰酸钾不按“反应Ⅱ”分解.对于这些猜测,肯定错误的是①(填序号),理由是化学反应前后,元素种类不变.
分析 (1)化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变.
(2)根据相对分子质量为构成分子的各原子的相对原子质量之和,根据高锰酸钾的质量结合方程式求解氧气的质量.
(3)化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变.
解答 解:(1)由2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2X 可知,反应前钾原子是4个,反应后应该是4个,其中2个包含在2X中,反应前后锰原子都是2个,反应前氧原子是10个,反应后应该是10个,其中2个包含在2X中,反应前氢原子是4个,反应后应该是4个,其中2个包含在2X中,因此反应Ⅰ中,X的化学式为KOH.
故填:KOH.
(2)高锰酸钾的相对分子质量为39+55+16×4=158.
设生成氧气的质量为x,
2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
316 32
15.8g x
$\frac{316}{15.8g}=\frac{32}{x}$,
x=1.6g,
答:反应生成氧气的质量是1.6g.
故答案为:158;1.6;
(3)①加热时,高锰酸钾中的钾、锰元素不能转化为氧元素;
②加热时,如果K2MnO4进一步分解并释放出氧气时,会导致产生的氧气质量偏大;
③如果加热温度不同时,高锰酸钾不按“反应Ⅱ”分解,可能会导致产生氧气的质量偏大;
因此肯定错误的是①,理由是化学反应前后,元素种类不变.
故填:①;化学反应前后,元素种类不变.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

| A. | 证明铜比银活泼:Cu+2AgCl═CuCl2+2Ag | |
| B. | 酸雨的形成原理:CO2+H2O═H2CO3 | |
| C. | 盐酸除铁锈(Fe2O3•nH2O):Fe2O3•nH2O+6HCl═2FeCl3+(n+3)H2O | |
| D. | 除去H2中混有的HCl气体:Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
| A. | 一种原子只能构成一种分子 | |
| B. | 质子数相等的粒子一定属于同种元素 | |
| C. | 原子得失电子形成离子时,其电子层数可能有变化 | |
| D. | 同种元素的粒子,其核外电子数一定相同 |
 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )| A. | 乙醇是由三种元素组成的化合物 | B. | 一个乙醇分子中含有26个质子 | ||
| C. | 乙醇中碳、氧元素的质量比为2:1 | D. | 乙醇中碳元素的质量分数最大 |
 根据如图实验所示,不能得出的结论是( )
根据如图实验所示,不能得出的结论是( )| A. | CO2 不能燃烧 | B. | CO2 不支持燃烧 | ||
| C. | CO2 密度比空气大 | D. | 蜡烛燃烧生成 CO2 和水 |
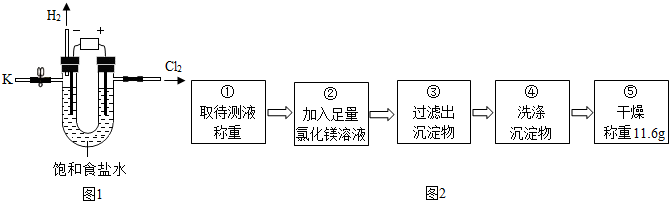
I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
