题目内容
15.小明同学在复习阶段在笔记本上对化学知识进行了归纳整理.下列说法正确的是( )①用pH试纸测得某地下水pH为5.2;
②粗盐提纯时需把蒸发皿中的水蒸干才能停止加热;
③洗涤剂厂用来洗涤油污,是因为洗涤剂能溶解油污;
④燃烧需要同时满足三个条件,故破坏其中一个条件就可以灭火;
⑤用果汁、小苏打、柠檬酸、凉开水等自制汽水;
⑥某些地区的雨水的pH=5.6,该雨水为酸雨;
⑦图书、档案、精密仪器等物失火,可用CO2灭火器;
⑧无色溶液中滴加酚酞溶液无现象,说明溶液呈中性.
| A. | ①③④ | B. | ③④⑧ | C. | ③⑤⑧ | D. | ④⑤⑦ |
分析 ①根据pH的读数方法分析;
②根据使用蒸发皿的注意事项分析;
③根据洗涤剂对油污的作用分析;
④根据灭火的原理分析;
⑤根据自制汽水的方法分析;
⑥根据酸雨的pH范围分析;
⑦根据二氧化碳灭火器的优点分析;
⑧根据酚酞试液在酸碱性溶液中的变色情况分析.
解答 解:①pH试纸测定的pH是粗略的数据,只能读整数,故错误;
②在蒸发皿中进行蒸发时,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干,故错误;
③洗涤剂厂用来洗涤油污,是因为洗涤剂具有乳化作用,不是溶解油污,故错误;
④燃烧需要同时满足三个条件,故破坏其中一个条件就可以灭火,故正确;
⑤小苏打和柠檬酸反应能够产生二氧化碳气体,因此可以用果汁、小苏打、柠檬酸、凉开水等自制汽水,故正确;
⑥正常雨水约为溶有二氧化碳pH约为5.6,而酸雨的pH是小于5.6,故错误;
⑦图书,档案,精密仪器等物失火使用二氧化碳灭火器可以不留下痕迹,减小损失,故正确;
⑧酚酞试液在酸性和中性溶液中都不变色,故错误.
故选D.
点评 本题属于基础性知识的考查,同时也是学生在学习过程中易错的知识点,要求在平时的学习中要扎实基础,灵活运用.

练习册系列答案
相关题目
6.下列化学方程式能正确表示所述内容的是( )
| A. | 证明铜比银活泼:Cu+2AgCl═CuCl2+2Ag | |
| B. | 酸雨的形成原理:CO2+H2O═H2CO3 | |
| C. | 盐酸除铁锈(Fe2O3•nH2O):Fe2O3•nH2O+6HCl═2FeCl3+(n+3)H2O | |
| D. | 除去H2中混有的HCl气体:Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
3.在密闭容器中有以下四种物质,它们在一定条件下充分反应,测得有关数据如表所示,下列说法不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 40 | 10 | 10 | 0 |
| 反应后质量/g | 6 | M | 28 | 16 |
| A. | 甲是化合物 | B. | 乙可能是催化剂 | ||
| C. | M=38 | D. | 此反应为分解反应 |
20.从分子的角度解释下列现象,错误的是( )
| A. | 汽油挥发--分子在不断运动 | |
| B. | 将氧气加压储存于钢瓶中--分子间隔随气压增大而变小 | |
| C. | 液体难被压缩--液态物质的分子间隔较小 | |
| D. | 液态水变水蒸气--分子是可分的 |
7.下列有关构成物质的粒子的说法正确的是( )
| A. | 一种原子只能构成一种分子 | |
| B. | 质子数相等的粒子一定属于同种元素 | |
| C. | 原子得失电子形成离子时,其电子层数可能有变化 | |
| D. | 同种元素的粒子,其核外电子数一定相同 |
4. 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )| A. | 乙醇是由三种元素组成的化合物 | B. | 一个乙醇分子中含有26个质子 | ||
| C. | 乙醇中碳、氧元素的质量比为2:1 | D. | 乙醇中碳元素的质量分数最大 |
5.某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图1所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.
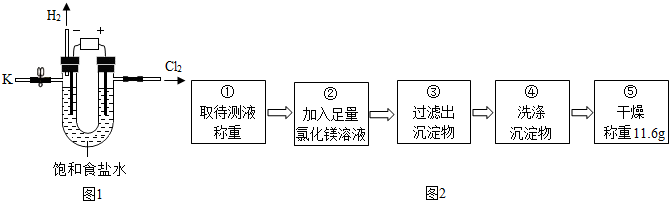
I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
【探究活动二】测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
(2)写出氢氧化钠与稀盐酸反应的化学方程式:NaOH+HCl═NaCl+H2O.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).

I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
 有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动.
有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动.