题目内容
17. 生活中常用的清洗剂.
生活中常用的清洗剂.| 名称 | 洁厕灵 | 炉具清洁剂 | 高效去污粉 | 消毒液 |
| 产品 样式 |  |  |  |  |
| 有效成分 | 盐酸 | 氢氧化钠 | 碳酸钠 | NaCl和NaClO |
(2)高效去污粉中加入足量的洁厕灵,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+CO2↑+H2O.
(3)消毒液成分中,NaClO中 Cl元素的化合价为+1价.工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,该反应的化学方程式为2NaOH+Cl2 ═NaCl+NaClO+H2O.
分析 (1)根据盐酸和氢氧化钠反应生成氯化钠和水写出反应的方程式;根据离子反应原理知生成物氯化钠以氯离子和钠离子形式存在,水主要以水分子存在分析a;
(2)根据碳酸钠和盐酸反应产生氯化钠、水和二氧化碳写出反应的方程式;
(3)根据在化合物中,正负化合价的代数和为零的原则,计算出NaClO中Cl的化合价为+1价;根据方程式书写的原理写出反应的方程式.
解答 解:(1)将洁厕灵与炉具清洁剂混合是盐酸和氢氧化钠反应生成氯化钠和水,反应的方程式为:NaOH+HCl═NaCl+H2O;盐酸和氢氧化钠反应,根据离子反应原理知生成物氯化钠以氯离子和钠离子形式存在,水主要以水分子存在,因此a微粒是水分子,符号为:H2O;
故答案为:NaOH+HCl═NaCl+H2O;H2O;
(2)高效去污粉中加入足量的洁厕灵是碳酸钠和盐酸反应产生氯化钠、水和二氧化碳,反应的方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
故答案为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
(3)根据在化合物中,正负化合价的代数和为零的原则,计算出NaClO中Cl的化合价为+1价,而氯化钠中Cl的化合价为-1价;
工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,成分为NaCl和NaClO,根据元素守恒可知生成物中还有水,因此反应的方程式为:2NaOH+Cl2 ═NaCl+NaClO+H2O;
故答案为:NaClO; 2NaOH+Cl2 ═NaCl+NaClO+H2O.
点评 本题主要以日常生活中常用的清洁剂为素材,考查了学生运用化学知识解决实际问题的能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
7.下列有关构成物质的粒子的说法正确的是( )
| A. | 一种原子只能构成一种分子 | |
| B. | 质子数相等的粒子一定属于同种元素 | |
| C. | 原子得失电子形成离子时,其电子层数可能有变化 | |
| D. | 同种元素的粒子,其核外电子数一定相同 |
5.某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图1所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分溶液作为待测液进行如下探究.
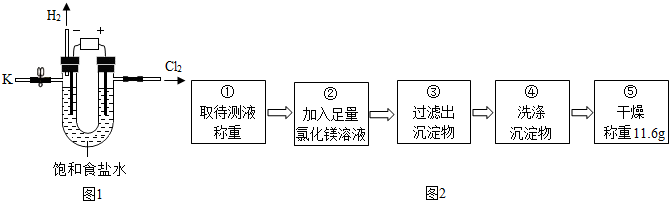
I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
【探究活动二】测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
(2)写出氢氧化钠与稀盐酸反应的化学方程式:NaOH+HCl═NaCl+H2O.
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).

I.请写出电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
Ⅱ.忽略其他可能发生的反应对本实验的影响.
【探究活动一】检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用滴定管【带有刻度并可逐滴加入液体的一种仪器】逐滴加入质量分数为10%的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据如表:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
(3)利用氢氧化钠与稀盐酸恰好完全反应时的实验数据,计算所称取待测液中氢氧化钠的质量,应选用稀盐酸的体积为9.8mL.还缺少的一个数据是稀盐酸的密度.
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液能发生反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
乙组同学按如图2所示的实验步骤进行实验.
(4)步骤②加入的氯化镁溶液必需足量,其目的是使氢氧化钠完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,取上层清液于试管中,向试管中滴加氢氧化钠溶液,产生白色沉淀,氯化镁已经过量(写出实验步骤、现象和结论).
(5)利用沉淀物的质量计算氢氧化钠的质量分数为16%(写出计算过程).
(6)若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
12.空气中体积分数含量最小的气体是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 氮气 | D. | 稀有气体 |
1.下列关于实验现象的描述,不正确的是( )
| A. | 在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 | |
| B. | 铝丝插入硫酸铜溶液中,铝丝表面有红色物质析出,溶液由蓝色变成无色 | |
| C. | 红磷在空气中燃烧,产生大量的白烟 | |
| D. | 铜与稀硫酸反应速率较慢,产生少量气泡 |
