题目内容
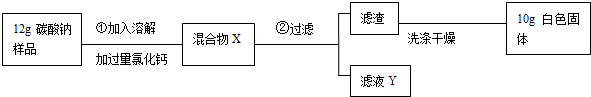
14.由红色粉末A(纯净物)开始的一系列变化如图所示.
已知无色液体E中的溶质是一种重要的调味品,常用来腌渍蔬菜、鱼、肉、蛋.在气体K中点燃固体H的细丝时,H剧烈燃烧,火星四射.试回答:
(1)写出指定物质的化学式:AFe2O3、BHCl、JCaCO3、LFe3O4.
(2)写出A与F反应的化学方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,C转化为D反应的化学方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
分析 根据题目中的信息“无色液体E中的溶质是一种重要的调味品,常用来腌渍蔬菜、鱼、肉、蛋”,则推测E为氯化钠;根据“在气体K中点燃固体H的细丝时,H剧烈燃烧,火星四射”,则推测K为氧气,H为铁,结合图框知L为四氧化三铁;结合图框,则推测红色粉末A为氧化铁,则B为稀盐酸、C为氯化铁、D为氢氧化铁、F为一氧化碳、G为二氧化碳、J为碳酸钙,代入检验,符合题意.
解答 解:根据题目中的信息“无色液体E中的溶质是一种重要的调味品,常用来腌渍蔬菜、鱼、肉、蛋”,则推测E为氯化钠;根据“在气体K中点燃固体H的细丝时,H剧烈燃烧,火星四射”,则推测K为氧气,H为铁,结合图框知L为四氧化三铁;结合图框,则推测红色粉末A为氧化铁,则B为稀盐酸、C为氯化铁、D为氢氧化铁、F为一氧化碳、G为二氧化碳、J为碳酸钙,代入检验,符合题意.故:
(1)根据分析可知:A为氧化铁,B为稀盐酸、J为碳酸钙、L为四氧化三铁,故其化学式分别为:Fe2O3、HCl、CaCO3、Fe3O4.
(2)根据分析可知:红色粉末A为氧化铁,F为一氧化碳,则A与F反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
C是氯化铁,氯化铁和氢氧化钠反应产生氢氧化铁沉淀和氯化钠,反应的方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
故答案为:
(1)HCl、CaCO3、Fe3O4.
(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
点评 本题为框图式推断题,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可.

| A. | 具有相同核电荷数(即核内质子数)的一类原子的总称 | |
| B. | 是相对原子质量相同的一类原子的总称 | |
| C. | 是具有相同电子数的一类原子的总称 | |
| D. | 是具有相同中子数的一类原子的总称 |
| A. | H2S和SO2 | B. | SO2和SO3 | C. | SO3和H2SO4 | D. | H2SO4和H2S |
[设计实验]
用一氧化碳还原纯净的氧化铁粉末,实验装置如图.
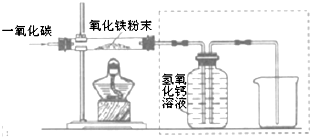
[进行实验]
该小组按上述实验设计,在一定温度下进行了实验,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却到室温称量)
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家提出查阅资料.
[查阅资料]
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁.
[实验与猜想]
①该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②进行猜想:黑色固体粉末可能
a.全部为铁 b.全部是四氧化三铁 c铁与四氧化三铁的混合物.
[得出结论]
通过实验中获得的数据进行计算,得出黑色固体粉末为(写名称)四氧化三铁.
[反思与评价]
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图中采用虚线框内的装置,其作用有A、B.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
| A. | 7.2g | B. | 5.8g | C. | 4.4g | D. | 9.5 g |