题目内容
9.2.4g镁和2.7g铝分别与足量稀硫酸反应,各产生氢气多少克?分析 镁与稀硫酸反应生成硫酸镁和氢气,铝与稀硫酸反应生成硫酸铝和氢气,由参加反应的镁和铝的质量,计算出生成氢气的质量即可.
解答 解:设镁与稀硫酸反应生成氢气的质量为x,
Mg+H2SO4═MgSO4+H2↑
24 2
2.4g x
$\frac{24}{2}=\frac{2.4g}{x}$ x=0.2g.
设2.7g铝与稀硫酸反应生成氢气的质量为y,
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 6
2.7g y
$\frac{54}{6}=\frac{2.7g}{y}$ y=0.3g.
答:各产生氢气的质量分别是0.2g、0.3g.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
20.下列净水方法中,对水的净化程度相对较高的是( )
| A. | 过滤 | B. | 蒸馏 | C. | 吸附沉淀 | D. | 静置沉淀 |
4.下列实验方法不能证明空气存在的是( )
| A. | 将空的集气瓶瓶口向下浸入水中,水不能进入集气瓶中 | |
| B. | 将由射器栓塞拉到10mL刻度处,用食指抵住针孔,栓塞不能推到底部 | |
| C. | 伽利略在比萨斜塔上将两个大小不同的铁球同时落下,发现两铁球同时着地 | |
| D. | 晓明在家中阳台上将玻璃弹子和纸片同时丢下,发现玻璃弹子先着地、纸片后着地 |
18.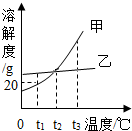 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )
 根据如图的溶解度曲线,判断下列说法不正确的是( )
根据如图的溶解度曲线,判断下列说法不正确的是( )| A. | 甲物质的溶解度随温度的升高而增大 | |
| B. | t1℃时,甲的饱和溶液中溶质和溶剂的质量比为1:5 | |
| C. | t2℃时,甲、乙两物质的溶解度相等 | |
| D. | 将t3℃时甲、乙两物质的饱和溶液降温到t1℃,甲析出的晶体多 |