题目内容
1.下列原子中的粒子,带负电荷的是( )| A. | 电子 | B. | 中子 | C. | 质子 | D. | 原子核 |
分析 原子是由带正电的原子核和带负电的核外电子构成的,原子核是由带正电的质子和不带电的中子构成.
解答 解:A、电子带负电荷,故此项正确.
B、中子不带电荷,呈电中性,此项错误.
C、质子带正电荷,不带负电,此项错误.
D、原子核带正电,故此项错误.
故选A.
点评 同学们要理解原子的内部结构,明确各种粒子所呈的电性.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
11.如图是固体物质M在水中的溶解度曲线,下列说法错误的是( )
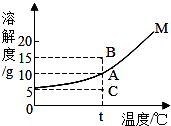

| A. | 图中A点表示t℃下,物质M的溶解度为10g | |
| B. | t℃下,A、C两点等质量的M溶液中,M的质量分数关系是C点大于A点 | |
| C. | C点表示t℃下物质M的不饱和溶液 | |
| D. | t℃下,欲将组成在C点的M溶液转变为A点的M溶液,可采用恒温蒸发水的方法 |
13.实验小组的同学研究二氧化碳的性质,实验方案如下.
注:乙醇在实验中只作为溶剂,不参与化学反应.
(1)实验操作①中,甲内发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.
(2)甲中出现胶状白色沉淀的原因是碳酸钠在乙醇中的溶解度小.
(3)实验操作②的目的是证明了CO2能和NaOH反应.
(4)如果将上述实验方案中的氢氧化钠乙醇溶液换为氢氧化钠水溶液,能(填“能”或“不能”)完成实验目的.
注:乙醇在实验中只作为溶剂,不参与化学反应.
| 实验装置 | 实验操作 | 实验现象 |
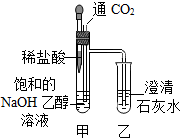 | ①向饱和的NaOH乙醇溶液中缓慢通入CO2 | 甲中出现胶状白色沉淀,乙中无明显现象 |
| ②滴入稀盐酸 | 甲中有气泡生成,乙中澄清石灰水变浑浊 |
(2)甲中出现胶状白色沉淀的原因是碳酸钠在乙醇中的溶解度小.
(3)实验操作②的目的是证明了CO2能和NaOH反应.
(4)如果将上述实验方案中的氢氧化钠乙醇溶液换为氢氧化钠水溶液,能(填“能”或“不能”)完成实验目的.
 判断下列说法错误的是D.
判断下列说法错误的是D.