题目内容
11.如图是固体物质M在水中的溶解度曲线,下列说法错误的是( )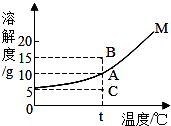
| A. | 图中A点表示t℃下,物质M的溶解度为10g | |
| B. | t℃下,A、C两点等质量的M溶液中,M的质量分数关系是C点大于A点 | |
| C. | C点表示t℃下物质M的不饱和溶液 | |
| D. | t℃下,欲将组成在C点的M溶液转变为A点的M溶液,可采用恒温蒸发水的方法 |
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:A、通过分析溶解度曲线可知,图中A点表示t℃下,物质M的溶解度为10g,故A正确;
B、t℃下,A、C两点等质量的M溶液中,A是饱和溶液,C是不饱和溶液,所以M的质量分数关系是C点小于A点,故B错误;
C、C点位于溶解度曲线下面,所以C点表示t℃下物质M的不饱和溶液,故C正确;
D、C点表示t℃下物质M的不饱和溶液,t℃下,欲将组成在C点的M溶液转变为A点的M溶液,可采用恒温蒸发水的方法,故D正确.
故选:B.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
2.分析处理图表中的信息是学习化学的一种重要方法.
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
(2)40℃时,氯化钠的溶解度为36.6g.
(3)碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g的水加入到30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”).将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%).
(4)10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
(1)如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(3)碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g的水加入到30g碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”).将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%(计算结果精确到0.1%).
(4)10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
19.下图所示实验操作正确的是( )
| A. | 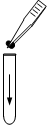 向试管中加入锌粒 | B. |  闻气体气味 | ||
| C. |  给铝片加热 | D. | 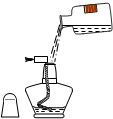 向酒精灯中加酒精 |
16.现用质量分数为98%的浓硫酸(密度是1.84g•cm-3)配制560g质量分数为14%的稀硫酸时,下列有关叙述正确的是( )
| A. | 配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯 | |
| B. | 配制稀硫酸时,用天平称量所需浓硫酸的质量 | |
| C. | 将80克硫酸倾倒入盛有80 mL98%浓硫酸的500 mL量筒中,并不断搅拌 | |
| D. | 将43.5mL 98%的浓硫酸沿1000mL烧杯内壁缓缓倒入481.6 mL水中,并不断搅拌 |
3.氯化钾的溶解度曲线如图所示,下列说法正确的是( )


| A. | 升高温度可使接近饱和的氯化钾溶液变为饱和溶液 | |
| B. | 40℃时,氯化钾饱和溶液中溶质的质量分数为40% | |
| C. | 50g水中加入20g氯化钾充分溶解,形成氯化钾饱和溶液 | |
| D. | 10℃时,65.5g氯化钾的饱和溶液中加入5g氯化钾,充分溶解后将温度升高到40℃,得到70g氯化钾饱和溶液 |
20.下列应用的原理正确的是( )
| A. | 用赤铁矿和一氧化碳炼铁:CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Fe+CO2 | |
| B. | 用盐酸除铁锈:Fe2O3+6HCl═2FeCl2+3H2O | |
| C. | 用酒精做燃料:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O | |
| D. | 用红磷测空气中氧气的含量:4P+5O2═2P2O5 |
1.下列原子中的粒子,带负电荷的是( )
| A. | 电子 | B. | 中子 | C. | 质子 | D. | 原子核 |