题目内容
13.实验小组的同学研究二氧化碳的性质,实验方案如下.注:乙醇在实验中只作为溶剂,不参与化学反应.
| 实验装置 | 实验操作 | 实验现象 |
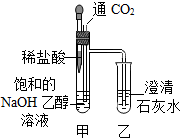 | ①向饱和的NaOH乙醇溶液中缓慢通入CO2 | 甲中出现胶状白色沉淀,乙中无明显现象 |
| ②滴入稀盐酸 | 甲中有气泡生成,乙中澄清石灰水变浑浊 |
(2)甲中出现胶状白色沉淀的原因是碳酸钠在乙醇中的溶解度小.
(3)实验操作②的目的是证明了CO2能和NaOH反应.
(4)如果将上述实验方案中的氢氧化钠乙醇溶液换为氢氧化钠水溶液,能(填“能”或“不能”)完成实验目的.
分析 (1)根据二氧化碳与氢氧化钠的反应分析回答;
(2)根据甲中出现胶状白色沉淀分析碳酸钠的溶解性;
(3)根据实验的过程及现象分析实验的目的;
(4)根据二氧化碳与氢氧化钠的反应生成了碳酸钠,碳酸钠能与盐酸反应生成了二氧化碳分析.
解答 解:(1)二氧化碳与氢氧化钠的反应生成了碳酸钠和水,所以在实验操作①中,甲内发生反应的是化学方程式为:2NaOH+CO2=Na2CO3+H2O.
(2)甲中出现胶状白色沉淀的原因是:碳酸钠在乙醇中的溶解度小.
(3)由于碳酸钠能与盐酸反应生成了二氧化碳,二氧化碳能使澄清的石灰水变浑浊,所以实验操作②的目的是证明了CO2能和NaOH反应.
(4)由于 二氧化碳与氢氧化钠的反应生成了碳酸钠,碳酸钠能与盐酸反应生成了二氧化碳,二氧化碳能使澄清的石灰水变浑浊.所以如果将上述实验方案中的氢氧化钠乙醇溶液换为氢氧化钠水溶液,能完成实验目的.
故答为:(1)2NaOH+CO2=Na2CO3+H2O;(2)碳酸钠在乙醇中的溶解度小;(3)证明了CO2能和NaOH反应等;(4)能.
点评 本题的难度不大,了解二氧化碳与氢氧化钠、碳酸钠与盐酸、二氧化碳与氢氧化钙的反应及反应的现象是解答本题的关键知识.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
3.氯化钾的溶解度曲线如图所示,下列说法正确的是( )


| A. | 升高温度可使接近饱和的氯化钾溶液变为饱和溶液 | |
| B. | 40℃时,氯化钾饱和溶液中溶质的质量分数为40% | |
| C. | 50g水中加入20g氯化钾充分溶解,形成氯化钾饱和溶液 | |
| D. | 10℃时,65.5g氯化钾的饱和溶液中加入5g氯化钾,充分溶解后将温度升高到40℃,得到70g氯化钾饱和溶液 |
4.下列属于纯净物的是( )
| A. | 生铁 | B. | 矿泉水 | C. | 硬水 | D. | 蒸馏水 |
1.下列原子中的粒子,带负电荷的是( )
| A. | 电子 | B. | 中子 | C. | 质子 | D. | 原子核 |
8.阅读下面科普短文.
亚硝酸盐广泛存在于自然环境和我们的生活中,就像空气一样平凡.在粮食、豆类、蔬菜、肉类、蛋类等食物中,都可以检测出一定量的亚硝酸盐.蔬菜中一般都含有硝酸盐,含量高的是茎叶类蔬菜、其次是根茎类蔬菜、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐.
大剂量的亚硝酸盐能够将人体内血红素中的铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧,即产生亚硝酸盐中毒.当体内+3价铁血红蛋白达到20%~40%就会出现缺氧症状,达到70%以上可导致死亡.
亚硝酸盐控制在安全范围内使用,是不会对身体造成危害的,而且它对预防致命的肉毒梭菌中毒具有不可替代的作用.我国和许多国家都批准把亚硝酸盐作为食品添加剂以防止食品腐败、改进肉类颜色.亚硝酸盐与肌肉中的乳酸作用会产生亚硝胺,亚硝胺不稳定易分解产生一氧化氮,一氧化氮与肌红蛋白结合产生红色的亚硝基肌红蛋白,使肉制品产生稳定的红色.
为了测定煮熟后的蔬菜中亚硝酸盐含量,研究人员选用白菜进行了测定.实验1温度为20℃,实验2温度为13℃,实验中分别取放置2、4、6、8、10、12、24小时的熟白菜汁3滴,滴入1滴稀硫酸,再滴入2滴0.03%高锰酸钾溶液,若溶液的紫红色褪去,表示含有亚硝酸盐.实验记录见下表:
依据文章内容,回答下列问题.
(1)高锰酸钾溶液中的溶质是高锰酸钾.
(2)亚硝酸盐使人体中毒的原因亚硝酸盐能将人体内血红素中铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧.
(3)下列有关亚硝酸盐的说法正确的是AC(填字母序号).
A.煮熟蔬菜中的硝酸盐会被逐渐分解为亚硝酸盐
B.温度越低,熟蔬菜中亚硝酸盐产生的速率越快
C.亚硝酸盐与肌肉中的乳酸作用产生亚硝胺发生的是化学变化
(4)为了减少蔬菜中硝酸盐的含量,在种植过程中应该适当减少氮肥的施用.
(5)根据实验现象,你对一次吃不完的熟蔬菜的建议是低温下贮存;②尽早食用.
亚硝酸盐广泛存在于自然环境和我们的生活中,就像空气一样平凡.在粮食、豆类、蔬菜、肉类、蛋类等食物中,都可以检测出一定量的亚硝酸盐.蔬菜中一般都含有硝酸盐,含量高的是茎叶类蔬菜、其次是根茎类蔬菜、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐.
大剂量的亚硝酸盐能够将人体内血红素中的铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧,即产生亚硝酸盐中毒.当体内+3价铁血红蛋白达到20%~40%就会出现缺氧症状,达到70%以上可导致死亡.
亚硝酸盐控制在安全范围内使用,是不会对身体造成危害的,而且它对预防致命的肉毒梭菌中毒具有不可替代的作用.我国和许多国家都批准把亚硝酸盐作为食品添加剂以防止食品腐败、改进肉类颜色.亚硝酸盐与肌肉中的乳酸作用会产生亚硝胺,亚硝胺不稳定易分解产生一氧化氮,一氧化氮与肌红蛋白结合产生红色的亚硝基肌红蛋白,使肉制品产生稳定的红色.
为了测定煮熟后的蔬菜中亚硝酸盐含量,研究人员选用白菜进行了测定.实验1温度为20℃,实验2温度为13℃,实验中分别取放置2、4、6、8、10、12、24小时的熟白菜汁3滴,滴入1滴稀硫酸,再滴入2滴0.03%高锰酸钾溶液,若溶液的紫红色褪去,表示含有亚硝酸盐.实验记录见下表:
| 时间/h | 2 | 4 | 6 | 8 | 10 | 12 | 24 |
| 实验1 | 不褪色 | 不褪色 | 不褪色 | 由稍褪色到褪色且速度逐渐加快 | |||
| 实验2 | 不褪色 | 不褪色 | 不褪色 | 不褪色 | 不褪色 | 褪色且速度加快 | |
(1)高锰酸钾溶液中的溶质是高锰酸钾.
(2)亚硝酸盐使人体中毒的原因亚硝酸盐能将人体内血红素中铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧.
(3)下列有关亚硝酸盐的说法正确的是AC(填字母序号).
A.煮熟蔬菜中的硝酸盐会被逐渐分解为亚硝酸盐
B.温度越低,熟蔬菜中亚硝酸盐产生的速率越快
C.亚硝酸盐与肌肉中的乳酸作用产生亚硝胺发生的是化学变化
(4)为了减少蔬菜中硝酸盐的含量,在种植过程中应该适当减少氮肥的施用.
(5)根据实验现象,你对一次吃不完的熟蔬菜的建议是低温下贮存;②尽早食用.
5.关于实验室用过氧化氢、氯酸钾、高锰酸钾制取氧气的反应,下列说法正确的是( )
| A. | 都需要加热 | B. | 都需要催化剂 | ||
| C. | 都有元素化合价的升降 | D. | 都有氧化物生成 |
14.在“蜡烛及其燃烧探究实验”中,属于化学变化的是( )
| A. | 燃烧中石蜡融化 | B. | 产物水蒸气凝结成小水珠 | ||
| C. | 蜡烛刚熄灭时产生白烟 | D. | 产物CO2使澄清石灰水变浑浊 |